
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
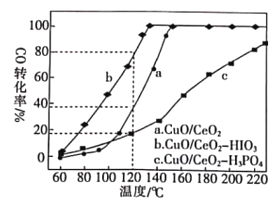
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
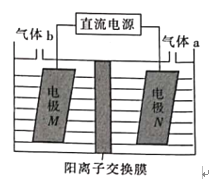
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
【答案】+131.45kJ/mol ![]() 0.0292molL-1min-1 Ce2(C2O4)3
0.0292molL-1min-1 Ce2(C2O4)3![]() 2CeO2+4CO↑+2CO2↑ 抑制 73.44 M极 2Cl- -2e-=Cl2↑ 5 Cl2+I2+6H2O=2HIO3+10HCl
2CeO2+4CO↑+2CO2↑ 抑制 73.44 M极 2Cl- -2e-=Cl2↑ 5 Cl2+I2+6H2O=2HIO3+10HCl
【解析】
(1)已知:①C(s)+![]() O2(g)═CO(g)△H1=-110.35kJmol-1
O2(g)═CO(g)△H1=-110.35kJmol-1
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJmol-1
③H2O(l)═H2O(g)△H3=+44.0kJmol-1
则:反应C(s)+H2O(g)═CO(g)+H2(g)可以是①+②×![]() -③得到,所以△H4=①+②×
-③得到,所以△H4=①+②×![]() -③=(-110.35kJmol-1)+(571.6kJmol-1)×
-③=(-110.35kJmol-1)+(571.6kJmol-1)×![]() -44.0kJmol-1=+131.45kJ/mol;
-44.0kJmol-1=+131.45kJ/mol;
反应C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数表达式为K=
CO(g)+H2(g)的平衡常数表达式为K=![]() ;
;
6min时生成0.7gH2,c(H2)=![]() ,根据反应C(s)+H2O(g)
,根据反应C(s)+H2O(g)![]() CO(g)+H2(g)可知,转化的c(CO)=c(H2),则6min内以CO表示的平均反应速率为υ(CO)=
CO(g)+H2(g)可知,转化的c(CO)=c(H2),则6min内以CO表示的平均反应速率为υ(CO)=![]() 0.0292molL-1min-1;
0.0292molL-1min-1;
(2)灼烧草酸铈[Ce(C2O4)3]分解制得CeO2、一氧化碳以及二氧化碳,反应方程式为:Ce2(C2O4)3![]() 2CeO2+4CO↑+2CO2↑;
2CeO2+4CO↑+2CO2↑;
相同时间内,CO的转化率越高,说明催化性能越好,由图象知道当H3PO4加入时,CO的转化率降低,则抑制CuO/CeO2的催化;
120℃时,CO的转化率是80%,气体混合物流速为1800mLmin-1;CO的体积分数为0.68%,则反应0.5小时后CO的体积为1800 mLmin-1×0.5h×60min/h×0.68%×(1-80%)=73.44mL;
(3)N极产生的气体a通入淀粉KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去,则气体a为Cl2,N极为阳极;则M是阴极,电极M上H+放电产生H2,促进M极附近水的电离,则LiOH在M极制得;N极为阳极,根据放电顺序,N极的电极反应式为2Cl- -2e-=Cl2↑;蓝色逐渐褪去是因为溶液中逐渐生成span>HIO3,说明Cl2将I2氧化成HIO3,则Cl2被还原成盐酸,反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,3.2 g 14C18O中含中子数为1.4NA
B. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
C. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如图实验:

(1)上述实验过程中发生反应的化学方程式为______。
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式___。
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为40%的氢氧化钾溶液的质量为___。
(4)样品中硫酸铜的质量分数为___。
(5)D烧杯溶液中溶质的质量分数为____。
(6)若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为多少?(写出计算过程)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
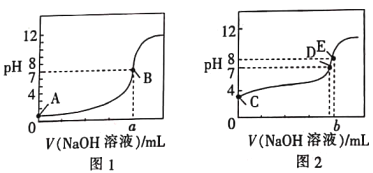
下列说法正确的是
A. 滴定醋酸的曲线是图1
B. 由图分析可得b>a=20
C. D点对应的溶液中:c(Na+)=c(A-)
D. 根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
(2)写出下列反应的离子方程式:
①金属A和水__________________________________________。
②物质B和气体乙_______________________________________。
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因_______________________。
(4)用化学方程式解释F长期放置在空气中失效的原因___________________________。
(5)红热细铁丝能在气体乙剧烈燃烧,现象是____________________,将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在_________之间。向氢氧化铁胶体中滴入过量稀硫酸,现象是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A. 此反应是氧化还原反应
B. 反应瞬间产生大量高温气体,推动火箭飞行
C. 在此反应中![]() 作还原剂
作还原剂
D. R的分子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为 0.1 mol·L-1 的盐酸和醋酸,下列说法正确的是
A. 两种溶液的 pH:盐酸大于醋酸
B. 用相同浓度的 NaOH 溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的 NaOH溶液体积多
C. 向醋酸中加入等物质的量的 NaOH,溶液呈碱性,且溶液中 ![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3B.Ba(NO3)2C.Na2SO4D.KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com