
【题目】利用如图所示装置可制备LiOH,两电极区电解液分别为LiCl溶液和LiOH溶液。下列说法错误的是

A. B极区的电极反应式2H2O+2e-=H2↑+2OH-
B. A极的电势一定比B极的高
C. 实际电解过程中A极区pH减小
D. 若改为阴离子交换膜,则两极气体产物仍相同
【答案】B
【解析】
电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,据此分析解答。
电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,
A.通过以上分析知,B为阴极,水电离产生的氢离子得电子产生氢气,电极反应式为2H2O+2e-=H2↑+2OH-,选项A正确;
B. 根据以上分析,A极为阳极,发生氧化反应,电流由电势高的一极流向电势低的一极,电子移动方向相反,选项B不正确;
C. 实际电解过程中A极区氯离子放电生成氯气,氯气与水反应生成盐酸和次氯酸,溶液显酸性,pH减小,选项C正确;
D. 若改为阴离子交换膜,则允许氢氧根离子移动到A极区,A极产生氯气,B极产生氢气,两极气体产物仍相同,只是两极溶液的浓度有差异,选项D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2
C.Na2O2、H2O2、H2O、O3D.HBr、CO2、H2O、CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖与蔗糖的说法错误的是( )。
A.二者的分子式不同,但所含化学元素相同
B.蔗糖能水解,葡萄糖不能水解
C.二者互为同分异构体
D.葡萄糖是单糖,能发生银镜反应,蔗糖是双糖,不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
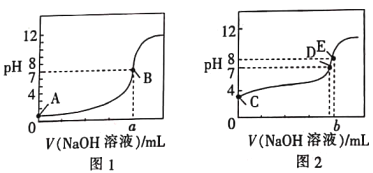
下列说法正确的是
A. 滴定醋酸的曲线是图1
B. 由图分析可得b>a=20
C. D点对应的溶液中:c(Na+)=c(A-)
D. 根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在燃烧2.24L(标准状况)CO与O2的混合气体时,放出11.32kJ的热量,最后产物的密度为原来气体密度的1.25倍,则CO的燃烧热为
A. 283 kJ·mol-1 B. -283 kJ·mol-1 C. -566 kJ·mol-1 D. 566kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A.碳酸氢钠可用于焙制糕点
B.晶体硅可用于制造太阳能电池
C.碳酸钡可用作医疗上检查肠胃的“钡餐”
D.常温下,可用铁制容器贮运浓硝酸、浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2A(g)+B(g) 2C(g) ΔH= -a kJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入 2 mol A 和 1 mol B,在 500 ℃时充分反应达到平衡后C 的浓度为 x mol·L-1,放出热量bkJ。请回答下列问题:
(1) a_____b(填“>”、“=”或“ <”)。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中 T1_____ T2(填“>”、“< ”或“ =”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.54×105 | 1.88×103 |
若在原来的容器中,只加入 2 mol C,500 ℃时充分反应达到平衡后,吸收热量 c kJ,则 C 的浓度_____x mol·L-1(填“>”、“=” 或“ <”),a、b、c 之间满足何种关系?_____(用代数式表示)
(3)在相同条件下要想得到 2a kJ 热量,加入各物质的物质的量可能是_____(填字母)。
A.4 mol A 和 2 mol B B.4 molA、2 mol B 和 2 mol C
C.4 mol A 和 4 mol B D.6 molA 和 4 mol B
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____(填字母)。
A.及时分离出C 气体 B.适当升高温度 C.增大 B 的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入 2 mol A 和 1 mol B,500 ℃时充分反应达到平衡后,放出热量 d kJ,则 d_____b(填“>”、“=” 或“ <”),理由是_____。
(6)在一定温度下,在一个容积不变的容器中通入 2 mol A 和 1 mol B 及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为 4 mol A 和 2 mol B,则平衡时A 的转化率_____(填“不变”、“变大”、“变小”或“不能确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com