
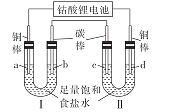
【题目】已知钴酸锂电池的总反应方程式为Li1-xCoO2+LixC6=LiCoO2+6C。用该电池作电源按如图所示装置进行电解。通电后,电极a上一直有气泡产生,电极d附近先出现白色沉淀(CuCl),t min后白色沉淀全部转变成橙黄色沉淀(CuOH)。下列有关叙述不正确的是
A.钴酸锂电池放电时的正极反应为Li1-xCoO2 +xe- +xLi+=LiCoO2
B.当电极a处产生标准状况下气体2. 24 L时。钴酸锂电池负极质量减少1.4g
C.电极d为阳极,电解开始时电极d的反应式为Cu+C1-- e- =CuCl
D.电解tmin后.装置II中电解质溶液的pH显著增大
【答案】D
【解析】
Ⅰ为电解饱和食盐水,电极a为铜棒,且一直有气泡产生,所以a为阴极,发生反应2H++2e===H2↑,则b为阳极,c为阴极,d为阳极。
A. 放电时为原电池,原电池正极失电子发生氧化反应,根据总反应可知放电时Li1-xCoO2 得电子生成LiCoO2,所以电极方程式为:Li1-xCoO2 +xe- +xLi+=LiCoO2,故A正确;
B. a电极发生反应2H++2e===H2↑,标况下2.24L氢气的物质的量为![]() =0.1mol,则转移的电子为0.2mol,钴酸锂电池负极发生反应LixC6=xLi++6C+xe-,当转移0.2mol电子时有0.2molLi+生成,所以负极质量减少0.2mol×7g/mol=1.4g,故B正确;
=0.1mol,则转移的电子为0.2mol,钴酸锂电池负极发生反应LixC6=xLi++6C+xe-,当转移0.2mol电子时有0.2molLi+生成,所以负极质量减少0.2mol×7g/mol=1.4g,故B正确;
C. 根据分析可知d为阳极,电极材料铜,所以铜在阳极被氧化,根据现象可知生成CuCl,所以电极方程式为Cu+C1-- e- =CuCl,故C正确;
D. 开始时阴极发生反应2H2O+2e===H2↑+2OH-,阳极发生Cu+C1-- e- =CuCl,可知生成的Cu+与OH-物质的量相等,t min后白色沉淀全部转变成橙黄色沉淀(CuOH),说明随着电解的进行发生反应CuCl+OH-═CuOH+Cl-,即电解过程生成的氢氧根全部沉淀,整个过程可用方程式:2H2O+2Cu= 2CuOH↓+ H2↑表示,可知溶液的pH值基本不变,故D错误;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)下列仪器中,与该滴定实验无关的为______。
A 胶头滴管 B 量筒(10ml) C 锥形瓶 D 滴定管夹
(2)量取一定体积的白醋所用的仪器_______(填“酸式”或“碱式”)滴定管. 实验中应选用______作指示剂。
(3)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ滴定前未用标准液润洗碱式滴定管______;
Ⅱ滴定结束时俯视滴定管刻度______
Ⅲ 盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失______
(4)在滴定过程中,当c(CH3COOˉ)< c(Na+)时,则混合溶液呈____(填序号)。
A 酸性 B 碱性 C 中性 D 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式为:有关M的下列叙述中正确的是( )
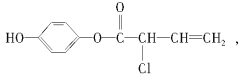
A.可与H2反应,1 mol M最多消耗5 mol H2
B.可与浓溴水反应,1 mol M最多消耗4 mol Br2
C.可与NaOH溶液反应,1 mol M最多消耗4 mol NaOH
D.M不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是重要的化石能源,其综合利用的研究意义重大。
已知;i.CH4(g)十H2O(g)![]() CO(g)+3H2(g) H=+206kJmol-1;
CO(g)+3H2(g) H=+206kJmol-1;
ii.CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H=+165kJmol-1;
CO2(g)+4H2(g) H=+165kJmol-1;
iii.C(s)十H2O(g)![]() CO(g)十H2(g) H=+131.4kJmol-1。
CO(g)十H2(g) H=+131.4kJmol-1。
请回答下列问题:
(1)若将物质的量之比为1:1的CH4(g)和H2O(g)充入密闭容器中发生反应i。CH4(g)和CO(g)的平衡体积分数(φ)与温度(T)的关系如图所示:
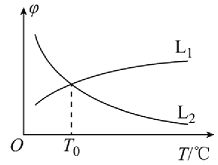
图中表示CH4(g)的平衡体积分数与温度关系的曲线为___(填“L1”或“L2”),原因为__。
(2)合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
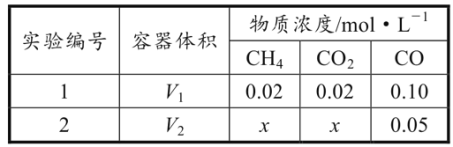
①H1=__。
②T℃下,该反应的平衡常数K=__。
③实验1中,CO的平衡体积分数为__%(保留三位有效数字)。
④V1:V2=_。
(3)甲烷在高温下分解生成的炭黑,是生成橡胶的重要原料,其分解原理为CH4(g)![]() C(s)+2H2(g)。
C(s)+2H2(g)。
①一定温度下,将n1molCH4充入1L恒容密闭容器中发生上述反应,tmin末容器内压强变为原来的1.6倍。tmin内该反应的平均反应速率v(H2)=__(用含n1和t的代数式表示)。
②若控制温度和压强不变,充入CH4的物质的量与平衡时H2的体积分数的关系如图所示。充入n1molCH4时,平衡点位于A点,则充入n2molCH4时,平衡点位于__(填“B”“C”或“D”)点。
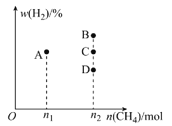
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合成材料的说法中,错误的是
A.聚氯乙烯可制成薄膜、软管等,其单体是CH2=CHCl
B.锦纶![]() 的单体是H2N(CH2)6NH2和HOOC(CH2)4COOH
的单体是H2N(CH2)6NH2和HOOC(CH2)4COOH
C.合成酚醛树脂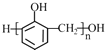 的单体是苯酚和甲醇
的单体是苯酚和甲醇
D.合成顺丁橡胶![]() 的单体是CH2=CH﹣CH=CH2
的单体是CH2=CH﹣CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )

A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],设计如图所示装置(夹持仪器略去)。
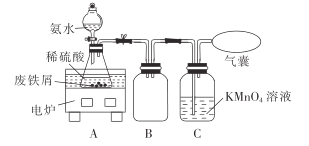
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60°C热水浴中加热.充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60° C热水浴的原因是___________
(2)装置B的作用是______________;KMnO4溶液的作用是______________。
(3)若要确保获得浅绿色悬浊液,下列不符合实验要求的是_________(填字母)。
a.保持铁屑过量 b. 控制溶液呈强碱性 c.将稀硫酸改为浓硫酸
(4)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加_______(填化学式)。
(5)产品中杂质Fe3+的定量
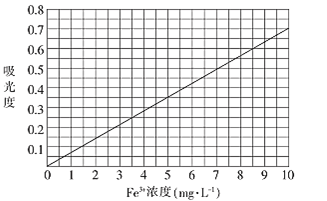
①配制Fe3+浓度为0.1 mg/mL的标准溶液100 mL。称取______ (精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
②将上述溶液稀释成浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______mg·L-1。
(6)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为_____ (用含c、V 、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com