
【题目】【加试题】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3351 kJ·molˉ1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是 , 该反应自发进行的条件 。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
①下列说法不正确的是
A.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为(用a、V表示)
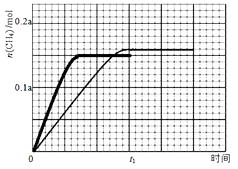
(3)350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
(4)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是 。
【答案】
(1)Al2O3(s)+ 3C(s)+ N2(g)===2Al(g) +3CO(g)+ 2AlN(s),ΔH=+1026 kJ·molˉ1;高温
(2)CD;625V2/a2
(3)
(4)CO2+ 6H2O +8eˉ === 6CH4+ 8OHˉ
【解析】解:(1) 通过观察已知三个方程式,用Al2O3合成AlN的方程式为
Al2O3(s)+3C(s)+N2(g)===2Al(g)+3CO(g)+2AlN(s),ΔH=(ΔH1+3ΔH2+2ΔH3)/2=+1026kJ·molˉ1 , 又∵ΔS>0,∴高温自发
由图一转化率随温度变化看出,350℃之前为未平衡之前的转化率,之后为CO2的平衡转化率,温度升高转化率降低,说明反应Ⅰ为放热反应A正确,C错误;从图2可以看出温度对生成产物(产物的选择性)有影响,B正确;相同条件下CO2和H2的初始体积比从1:4改变为1∶3,前者CO2的转化率高,D错误;故选择C、D
根据图一350℃ CO2的平衡转化率为0.8,三段式进行计算
CO2(g)+ | 4H2(g) | CH4(g)+ | 2H2O(g) | |
初n |
|
| 0 | 0 |
转化n |
|
|
|
|
平衡n |
|
|
|
|
代入求平衡常数K=[ ![]() a ×0.8×(
a ×0.8×( ![]() a ×1.6)2×
a ×1.6)2× ![]() ]/[
]/[ ![]() a ×0.2×(
a ×0.2×( ![]() a ×0.8)4×
a ×0.8)4× ![]() ]=625V2/a2
]=625V2/a2
(要除以体积转化为浓度之后代入)
t1时350℃达到平衡,反应为放热反应,400℃反应速率加快,平衡逆移动,后生成甲烷的量减少。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】请根据所给的方程式写出离子方程式.
(1)Na2CO3+BaCl2═2NaCl+BaCO3↓
(2)CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)CO2+2NaOH═Na2CO3+2H2O
(4)Fe2O3+6HCl═2FeCl3+3H2O
(5)Zn+2HCl═ZnCl2+H2↑ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加罗常数,下列叙述正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为NA
B.2.3gNa与足量的氧气发生反应,转移的电子数为0.2NA
C.通常情况下,32gO2与32gO3所含有的氧原子数均为2NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F的分子式为C12H14O2 , 其被广泛用作香精的调香剂.为了合成该物质,某实验室的科技人员设计了下列合成路线: 
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现种峰;峰面积之比为 .
(2)写出反应④⑤⑥的化学方程式:
④;
⑤;
⑥ .
(3)F有多种同分异构体,请写出符合下列条件的所有同分异构体的结构简式 .
①属于芳香族化合物,且含有与F相同的官能团;
②苯环上有两个取代基,且苯环上的一氯代物只有两种;
③其中一个取代基为﹣CH2COOCH3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】某研究小组按下列路线合成镇痛药哌替啶:
已知:
∣∣
请回答:
(1)A→B的反应类型是。
(2)下列说法不正确的是________。
A.化合物A的官能团是硝基
B.化合物B可发生消去反应
C.化合物E能发生加成反应
D.哌替啶的分子式是C15H21NO2
(3)写出B+C→D的化学反应方程式。
(4)设计以甲苯为原料制备C的合成路线(用流程图表示,无机试剂任选)。
(5)写出同时符合下列条件的C的所有同分异构体的结构简式。
①分子中有苯环而且是苯环的邻位二取代物;
②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.2 mol·L-1与0.1 mol·L-1 HClO溶液中c(H+)之比为2:1
B. pH=2和pH=1的硝酸中c(H+)之比为1:2
C. 25 ℃时,0.1 mol·L-1CH3COOH的电离平衡常数K=2×10-5,则0.1 mol·L-1CH3COONa的水解平衡常数为5×10-10
D. 0.1 mol·L-1NaHCO3溶液中:c (Na+)+ c (H+)+ c (H2CO3)<c (HCO3-) +3 c (CO32-) + c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( ) 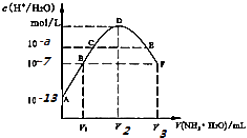
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14﹣a
C.E溶液中存在:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.B到D,D到F所加氨水体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________;所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式表示其原因:__________;所得溶液中各离子物质的量浓度由大到小的顺序是____________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH![]() )=a moL.L-1,则c(SO42-)为________。
)=a moL.L-1,则c(SO42-)为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com