
【题目】下列过程中所发生的化学变化,属于加成反应的是
A.光照射甲烷和氯气的混合气体
B.在镍做催化剂的条件下,苯与氢气反应
C.乙醇在铜或银做催化剂的条件下与氧气反应
D.乙酸在浓硫酸做催化剂的条件下与乙醇反应
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】下列关于如图所示转化关系(X代表卤素)的说法错误的是

A. ΔH3<0
B. ΔH1=ΔH2+ΔH3
C. 按Cl、Br、I的顺序,ΔH2依次增大
D. ΔH1越小,HX越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2) 提取铜的操作流程如图:。
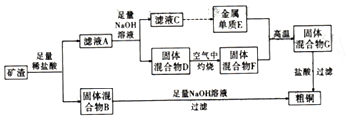
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)铁在元素周期表中的位置为___________;固体混合物B与氢氧化钠溶液反应的离子方程式为___________________。
(2)滤液A中铁元素的存在的离子形式为_______,.理由是_____________(用离子方程式表达,不必书写Cu2O 与盐酸的反应)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用多种试剂,请写出用最佳方案反应的离子方程式:_______________。
(4)工业上利用电解法进行粗铜精炼时,下列叙述正确的是______ (填序号)。
a.电解过程中,阳极质量的减轻量一定等于阴极质量的增加量
b.粗铜接电源正极,发生氧化反应
c.电解过程中,粗铜中所有杂质均被氧化
d.电解精炼过程中可以用硝酸银溶液作电解质溶液
(5)取320g固体混合物F 于硬质玻璃管中,通入足量氢气充分加热还原,固体质量减轻80g,若将所得的还原产物与足量稀盐酸反应,产生的H2在标准状况的体积为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,不正确的是( ) 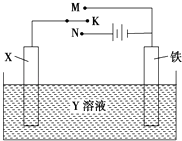
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
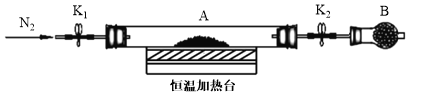
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 ________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
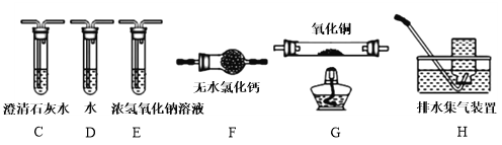
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
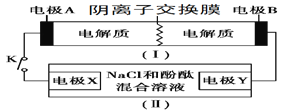
A. 闭合K时,X的电极反应式为:2H++2e-= H2↑
B. 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C. 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D. 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3mol Z,下列正确的是( )
A.60s内以X浓度变化表示的反应速率为0.001 mol/(L?s)
B.将容器体积变为20L,Z的平衡浓度变为原来的 ![]()
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:x A(g)+yB(g)pC(g)+qD(g)已知:平均反应速率Vc= ![]() Va , 反应2min时A的浓度减少了
Va , 反应2min时A的浓度减少了 ![]() ,B的物质的量减少了
,B的物质的量减少了 ![]() mol,有a mol D生成.回答下列问题:
mol,有a mol D生成.回答下列问题:
(1)化学反应方程式中,x= , y= , p= , q=
(2)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol 则该反应的△H0;(填“>、<或=”)
(3)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较: ①反应速率(填:“增大”“减小或“不变”).
②平衡时反应物的转化率(填:“增大”“减小或“不变”)理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关于氯及其化合物的说法不正确的是
A. 干燥的氯气可以使鲜花褪色
B. 氢气在氯气中安静地燃烧,发出黄色火焰,生成物溶于水可制得盐酸
C. 漂白粉的主要成分为CaCl2和Ca(ClO)2,有效成分为后者
D. 新制氯水中含有HClO,具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com