
【题目】实验室用如图装置制备HCl气体。

(1)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理是___(选填编号)。
a.浓硫酸吸收了盐酸中水分
b.混合时放热使HCl溶解度减小
c.浓盐酸中HCl以分子形式存在
d.浓盐酸密度小于浓硫酸
(2)为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:取5.00mL混合酸,加水稀释至500mL,完成此操作,用到的精确定量仪器有____;称量4.7880gBa(OH)2固体,溶于水配成250mL标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是___,请你填写标签上的空白。____
![]()
(3)从500mL稀释液中取出20.00mL,滴加几滴酚酞作指示剂,用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是__。
(4)为完成全部测定,接下来对锥形瓶中混合物进行的操作是___、称量、___。
(5)若固体Ba(OH)2中混有少量的NaOH,会导致混合酸中硫酸浓度的测定结果___(选填“偏大”、“偏小”、“无影响”)。
【答案】ab 500mL容量瓶、滴定管(或移液管) 避免滴定液被稀释,引起实验误差 ![]() 用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色) 过滤、洗涤、干燥 恒重 无影响
用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色) 过滤、洗涤、干燥 恒重 无影响
【解析】
(1)浓硫酸吸水,放出大量的热,有利于HCl的逸出;
(2)由量取混合酸体积精度,可以选择酸式滴定管量取,由配制溶液体积可以知道在500mL容量瓶中定容;装瓶前用标准溶液对试剂瓶进行润洗,避免滴定液被稀释,引起实验误差;
标签应注明物质的量浓度,根据n=m/M计算氢氧化钡物质的量,再根据c=n/V计算氢氧化钡溶液浓度;
(3)用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是:用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色);
(4)反应生成硫酸钡沉淀,进行过滤、洗涤、干燥,称量硫酸钡的质量,恒重时可得硫酸钡质量,根据硫酸根守恒可以计算硫酸的浓度,氢离子源于硫酸与HCl,结合氢氧根离子中和氢离子,可以计算HCl的物质的量浓度;
(5)硫酸转化为硫酸钡沉淀,根据硫酸钡的质量,由硫酸根守恒计算硫酸的物质的量。
(1)浓硫酸吸水,放出大量的热,使HCl溶解度减小,有利于HCl的逸出,可制备少量干燥HCl气体;答案:ab;
(2)由量取混合酸体积精度,可以选择酸式滴定管量取,由配制溶液体积可以知道在500mL容量瓶中定容;装瓶前用标准溶液对试剂瓶进行润洗,避免滴定液被稀释,引起实验误差;标签应注明物质的量浓度,氢氧化钡物质的量为![]() =0.02800mol,氢氧化钡溶液浓度为
=0.02800mol,氢氧化钡溶液浓度为![]() =0.1120mol/L;答案: 500mL容量瓶、滴定管(或移液管) 避免滴定液被稀释,引起实验误差
=0.1120mol/L;答案: 500mL容量瓶、滴定管(或移液管) 避免滴定液被稀释,引起实验误差 ![]() ;
;
(3)用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还可以用待测液返滴,直到出现颜色变成浅红色,还有可以采取的措施:用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色);答案:用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色);
(4)反应生成硫酸钡沉淀,进行过滤、洗涤、干燥,称量硫酸钡的质量,恒重时可得硫酸钡质量,根据硫酸根守恒可以计算硫酸的浓度,氢离子源于硫酸与HCl,结合氢氧根离子中和氢离子,可以计算HCl的物质的量浓度;
答案: 过滤、洗涤、干燥 恒重
(5)硫酸转化为硫酸钡沉淀,根据硫酸钡的质量,由硫酸根守恒计算硫酸的物质的量,固体Ba(OH)2中混有少量的NaOH,不影响混合酸中硫酸浓度的测定结果;答案:无影响。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、![]() 等气体
等气体
B.浓硫酸与单质硫反应的方程式为:2H2SO4(浓)+S![]() 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
C.把足量铜粉投入到只含![]() 的浓硫酸中,得到气体体积在标准状况下为
的浓硫酸中,得到气体体积在标准状况下为![]()
D.常温下能够用铁、铝等容器盛放浓![]() ,是因为浓
,是因为浓![]() 的强氧化性使其钝化
的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是
A.反应容器中压强不再变化B.反应容器中密度不再变化
C.X、Y、Z的浓度之比为2:1:1D.单位时间内生成1molY的同时生成2molX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A________,B________,C________,D________。
(2)写出C2B2的电子式:________
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)用电子式表示化合物C2D的形成过程:_____________________________________。
(5)A与D的最高价氧化物对应的水化物的浓溶液反应的化学方程式为:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置(化学位移,符号为δ)也就不同。下图所示的核磁共振图谱表示的是下列有机物中的( )
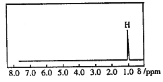
A. CH3C(CH3)3B. CH3CH2CH3
C. CH2=CHCH3D. (CH3)2CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语回答下列问题
(1)画出钾原子的原子结构示意图:____________。
(2)写出氨分子的结构式:__________________。
(3)用电子式表示氟化钙(CaF2)的形成过程:_________________。
(4)完成下表
K层为最外层时,最多能容纳的电子数 | _________ |
除K层外,其他各层为最外层时,最多能容纳的电子数 | _________ |
次外层最多能容纳的电子数 | _________ |
倒数第3层最多能容纳的电子数 | _________ |
第n层里最多能容纳的电子数 | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H3PO4
A.①④③②B.④③②①C.②③④①D.①④③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com