
【题目】核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置(化学位移,符号为δ)也就不同。下图所示的核磁共振图谱表示的是下列有机物中的( )
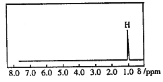
A. CH3C(CH3)3B. CH3CH2CH3
C. CH2=CHCH3D. (CH3)2CHCH3
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中还原剂是___________________(填化学式),被2 mol FeSO4还原的过氧化钠为_________mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+被氧化时,c为_____________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
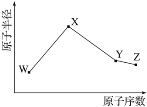
A.对应简单离子半径:X<W
B.对应简单气态氢化物的稳定性:Y<Z
C.化合物XZW既含离子键也含共价键
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁钉放入纯水中,一段时间后,铁钉表面有铁锈生成,下列说法正确的是
![]()
A.铁钉与水面交接处最易腐蚀
B.铁钉发生吸氧腐蚀,铁做阴极
C.铁发生的反应是:Fe-3e→Fe3+
D.水上和水下部分的铁钉不发生电化腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol甲烷与氯气发生取代反应,待反应完全后甲烷与氯气均无剩余,测知四种取代物物质的量相同,则消耗的氯气( )
A. 2molB. 10molC. 7.5molD. 16 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制备HCl气体。

(1)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理是___(选填编号)。
a.浓硫酸吸收了盐酸中水分
b.混合时放热使HCl溶解度减小
c.浓盐酸中HCl以分子形式存在
d.浓盐酸密度小于浓硫酸
(2)为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:取5.00mL混合酸,加水稀释至500mL,完成此操作,用到的精确定量仪器有____;称量4.7880gBa(OH)2固体,溶于水配成250mL标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是___,请你填写标签上的空白。____
![]()
(3)从500mL稀释液中取出20.00mL,滴加几滴酚酞作指示剂,用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是__。
(4)为完成全部测定,接下来对锥形瓶中混合物进行的操作是___、称量、___。
(5)若固体Ba(OH)2中混有少量的NaOH,会导致混合酸中硫酸浓度的测定结果___(选填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A与H2的相对密度为14,其产量可以用来衡量一个国家的石油化工发展水平。以该化合物为原料合成化合物G、E和I的流程如下:
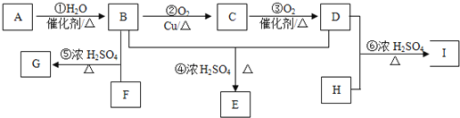
已知:Ⅰ.芳香族化合物F为C、H、O化合物,其相对分子质量为166,环上的一氯代物有一种,1molF与足量NaHCO3溶液反应能生成2molCO2,F与足量B反应生成G。
Ⅱ.H为二元醇,其蒸气密度折算成标准状况为2.77g/L,H与足量D反应生成I。
(1)A中官能团的名称为____________,E的结构简式_________________。
(2)G的分子式为_____________,反应⑤的反应类型为________________。
(3)写出下列化学方程式:②_______________________;
⑥___________________________。
(4)以乙烯为原料合成的加聚产物为![]() ,则单体是_______ 和_____。
,则单体是_______ 和_____。
(5)I有多种同分异构体,其中一类同分异构体有如下特征:
①分子中含有五元环结构;②1mol该有机物与足量NaHCO3溶液反应,能生成1 molCO2;③1mol该有机物与足量Na反应,能生成1.5 mol H2;④环上的一氯代物只有三种。则满足以上条件的有机物的所有可能的结构简式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
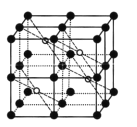
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O> ___。基态K+电子占据最高能级的电子云轮廓图为____形。
(2) NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是____,中心原子的杂化形式为____。NaBH4中存在____(填标号)。
a. 离子键 b. 氢键 c. σ键 d. π键
(3) BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为 ___,其中Be的配位数为_____。
(4)第三周期元素氟化物的熔点如下表:
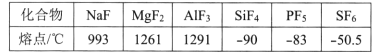
解释表中氟化物熔点变化的原因:____。
(5) CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是____。若r(F-)=x pm,r(Ca2+) =y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_____ g.cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写错误的是
A. 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-=2AlO2-+3H2↑
B. Al(OH)3溶于NaOH溶液中:Al(OH)3 +OH-=AlO2- +2H2O
C. 碳酸氢钠水解: HCO3-+H2O![]() OH-+CO2↑+H2O
OH-+CO2↑+H2O
D. FeCl2溶液中通入Cl2:2Fe2++Cl2 =2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com