
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6molCuFeS2制取6molCu时共消耗15molO2 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6 | |
| D. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 |
分析 A.二氧化硫能用来制取硫酸;
B.根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据方程式计算;
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S,还原剂是Cu2S,氧化产物是二氧化硫、还原产物是Cu;
D.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S.
解答 解:A.在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以所以冶炼过程中的尾气可用来制硫酸,故A正确;
B.总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据方程式知由6mol CuFeS2制取6 mol Cu时共消耗15mol O2,故B正确;
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S,还原剂是Cu2S,氧化产物是二氧化硫、还原产物是Cu,则氧化产物和还原产物的物质的量之比为1:6,故C正确;
D.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S,氧化产物是二氧化硫、还原产物是Cu,故D错误;
故选D.
点评 本题考查了氧化还原反应,根据元素化合价变化及方程式中各个物理量的关系分析解答,注意D选项中氧化剂的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 成语 | 化学原理 | |
| A | 炉火纯青 | 通过观察火焰的颜色来判断炉内的温度 |
| B | 火树银花 | 发生了焰色反应 |
| C | 百炼成钢 | 通过多次锻炼,使生铁中碳等杂质因挥发而降低达到了钢的标准 |
| D | 青出于蓝而胜于蓝 | 蓝色的靛蓝燃料发生化学反应生成一种深蓝色的新燃料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
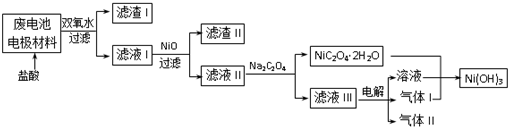
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol Cl2与过量的镁反应,转移 2NA个电子 | |
| B. | 常温常压下,16 g CH4含有 10NA个电子 | |
| C. | 1 mol•L -1 Na2SO4溶液中含有 NA个SO42- | |
| D. | 常温常压下,22.4 L CO2含有N A个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 主要原因 | |
| A | 燃煤中添加适量CaO可减少SO2排放量 | 燃烧中硫元素转化为CaSO3 |
| B | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| C | 夏天雷雨过后感觉到空气特别的清新 | 空气中O3含量增加、尘埃减少 |
| D | 蒸熟的糯米在适当条件可转化为香甜可口的甜酒 | 部分淀粉水解生成葡萄糖与乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
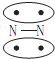 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示π键,下列说法中不正确的是 ( )
,其中椭圆框表示π键,下列说法中不正确的是 ( )| A. | N2分子与CO分子中都含有叁键 | |
| B. | CO分子中有一个π键是配位键 | |
| C. | N2、CO分别由非极性键和极性键结合,因此二者不是等电子体 | |
| D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA | |
| D. | 苯与液溴反应生成1mol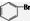 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
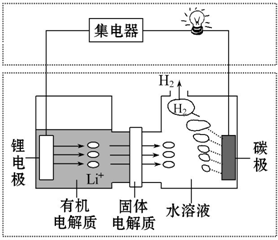
| A. | 碳极发生的反应:2H2O+2e-═H2↑+2OH- | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 理论上外电路中每转移1 mol电子,负极消耗的质量为7 g | |
| D. | 若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com