
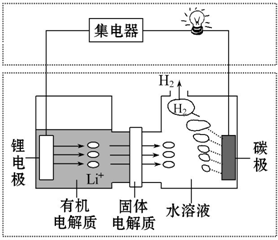
| A. | 碳极发生的反应:2H2O+2e-═H2↑+2OH- | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 理论上外电路中每转移1 mol电子,负极消耗的质量为7 g | |
| D. | 若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 |
分析 因锂与水反应,则形成原电池时锂为负极,碳为正极,且负极不能与水接触,负极反应为Li-e-=Li+,正极反应为2H2O+2e-=H2↑+2OH-,结合电极方程式解答该题.
解答 解:A.碳极上产生氢气,应该是正极,反应中水为氧化剂,氧气不参加反应,正极方程式为2H2O+2e-=H2↑+2OH-,故A正确;
B.由于金属Li可以和水之间反应生成氢氧化锂和氢气,但是和有机电解质不反应,所以有机电解质通过固体电解质不可进入水溶液中,故B正确;
C.理论上,外电路中每转移1mol电子,由Li-e-=Li+可知消耗1moLi,质量为7g,故C正确;
D.充电时,锂电极发生还原反应生成Li,应连接电源负极,故D错误.
故选D.
点评 本题考查新型电池,为高频考点,侧重于学生的分析能力的考查,题目难度不大,解答本题的关键是根据物质的性质判断电极反应,并能书写有关反应的离子方程式.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6molCuFeS2制取6molCu时共消耗15molO2 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6 | |
| D. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及生物质能的利用 | |
| C. | 煤的主要成分为单质碳、苯、二甲苯等,因而可通过煤的干馏将它们分离 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论或解释 |
| A | 用pH计或pH试纸分别测定饱和SO2水溶液和饱和CO2水溶液的pH值 | 饱和SO2水溶液的pH值小于饱和CO2水溶液 | 亚硫酸强于碳酸 |
| B | 向加热KClO3制氧气后的残余固体中加入浓H2SO4,继续加热 | 产生黄绿色气体 | 浓硫酸与残渣中的KCl发生反应生成了Cl2 |
| C | 加热装在试管中的NH4Cl晶体 | 试管底部的晶体消失,试管上部有晶体凝结. | NH4Cl晶体发生了升华. |
| D | 将一根较粗的铜丝在酒精灯火焰上加热到红热,然后趁热插入乙醇中一会儿取出. | 铜丝先变黑后又变红,乙醇中伴有刺激性气味产生. | 铜丝发生了几个反应,但铜丝前后的质量不变. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
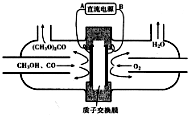
| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: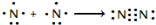 .
.| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用固体氢氧化钠配制标准溶液时其中混有Na2O杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现碱式滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com