
【题目】现有反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,X为生成物,其分子式应为
A. NH4Cl B. NO C. N2 D. NO2
科目:高中化学 来源: 题型:
【题目】把下列现象中硫酸所表现出来的性质填写在空白处:
(1)把锌粒放入稀硫酸中时,有气体放出 _____________;
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 _____________;
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑 _____________;
(4)把木炭放入热的浓硫酸中时,有气体放出 _____________;
(5)在常温下可以用铁、铝制容器盛装冷的浓硫酸 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
【答案】C
【解析】由电荷守恒可知c(NH4+)+c(H+)=2c(SO42-)+c(OH-),当pH=7时,c(NH4+)=2c(SO42-),故A项错;醋酸是弱酸,浓度越大,电离程度越小,当两溶液pH相差1时,c1≠10c2,B项错;pH=11的NaOH与pH=3的醋酸等体积混合后溶液显酸性,滴入石蕊试液呈红色,C项对;氨水存在电离平衡:NH3·H2ONH4++OH-,加(NH4)2SO4固体,平衡左移,导致 减小,D项错。
减小,D项错。
【题型】单选题
【结束】
20
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.  <1.0×10-7mo1/L
<1.0×10-7mo1/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于分子晶体的一组物质是( )
A. CaO、NO、CO B. CCl4、H2O、He
C. CO2、SO2、NaCl D. CH4、O2、Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2分别为A在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1减小,α2增大 B. α1增大,α2减小
C. α1、α2均减小 D. α1、α2均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取乙酸乙酯。
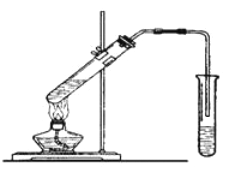
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下: _________________________,然后轻振荡使其混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是 _______________________________________________。
(3)浓硫酸的作用是:① _______________; ② ______________。
(4)图中右边试管中试剂是 _____________________________。
(5)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式______________________________________
(7)写出乙酸与碳酸氢钠反应方程式_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧热的热化学方程式为________(填选项字母)。
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+![]() O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+________![]() ________+________
________+________
④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:_____________;请根据“绿色化学”的思想评估该方法制H2的主要缺点:___________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。

请写出化学方程式:
反应①__________________________。
反应②__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com