
【题目】实验室用下图所示的装置制取乙酸乙酯。
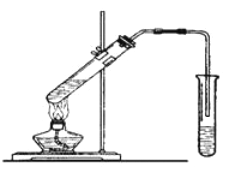
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下: _________________________,然后轻振荡使其混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是 _______________________________________________。
(3)浓硫酸的作用是:① _______________; ② ______________。
(4)图中右边试管中试剂是 _____________________________。
(5)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式______________________________________
(7)写出乙酸与碳酸氢钠反应方程式_______________________________________________
【答案】 向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸 挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减少引起倒吸 催化剂 吸水剂 饱和碳酸钠溶液 分液 分液漏斗,烧杯 CH3COOH+CH3CH218OH ![]() CH3CO18OCH2CH3 + H2O CH3COOH + NaHCO3 === CH3COONa + CO2 ↑ + H2O
CH3CO18OCH2CH3 + H2O CH3COOH + NaHCO3 === CH3COONa + CO2 ↑ + H2O
【解析】(1)制取乙醇、乙酸和浓硫酸的混合液时,正确操作方法为:向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸,故答案为:向大试管中注入适量乙醇,将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸;
(2)乙醇和乙酸的沸点较低,反应过程中容易挥发,由于挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小引起倒吸现象,故答案为:挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小引起倒吸;
(3)浓硫酸在乙酸乙酯的制取反应中,能够加快反应速率,起到了催化剂作用,能够吸收反应生成的水,通过了乙酸乙酯的产率,起到了吸水剂的作用,故答案为:催化剂;吸水剂;
(4)乙酸乙酯在饱和碳酸钠溶液中溶解度减小,且饱和碳酸钠溶液能够吸收挥发出来的乙酸和乙醇,所以吸收乙酸乙酯使用的是饱和碳酸钠溶液,故答案为:饱和碳酸钠溶液;
(5)乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液分层,可以通过分液操作将乙酸乙酯分离出来;分液操作使用的仪器有分液漏斗、烧杯等,故答案为:分液;分液漏斗、烧杯;
(6)乙酸与乙醇生成乙酸乙酯的反应中,乙醇脱去羟基中的氢原子、乙酸脱去羧基中的羟基,所以18O反应后进入乙酸乙酯中,该反应的化学方程式为CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O,故答案为:CH3COOH+CH3CH218OH
CH3CO18OCH2CH3+H2O,故答案为:CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O;
CH3CO18OCH2CH3+H2O;
(7)乙酸与碳酸氢钠反应生成乙酸钠、二氧化碳和水,反应的化学方程式为CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O,故答案为:CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.硫酸、CuSO45H2O,苛性钾
B.硫酸、空气、纯碱
C.氧化铁、胆矾、熟石灰
D.硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+![]() O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ① B. ④ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+K+ SO42﹣ HCO3﹣
B.Cu2+ K+ SO42﹣ NO3﹣
C.Na+ K+ Cl﹣ NO3﹣
D.Al3+ K+ SO42﹣OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,X为生成物,其分子式应为
A. NH4Cl B. NO C. N2 D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)硅的最高价氧化物对应水化物化学式可能是_____。
A.H4SiO3 B.H2SiO3 C.H3SiO4 D.HSiO4
(2)金刚石与金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以共价 单键相结合。金刚砂属于_____晶体。金刚砂的熔点比金刚石的熔点_____;金刚砂的结构中,一个硅原子周围结合_____个碳原子。
(3)晶体硅的微观结构与金刚石相似,晶体硅中 Si—Si 键之间的夹角大小约为_____。 下表列有三种物质(晶体)的熔点:
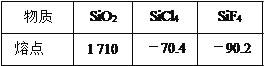
简要解释熔点产生差异的原因:
①SiO2 和 SiCl4:_________________________;
②SiCl4和 SiF4:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.Sic与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。

①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,相对原子质量Ga∶70,As∶75,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的结晶水合物在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体( Na 2CO3·nH2O )。为测定其组成,某同学在不同温度下加热样品(温度逐渐升高),实验结果记录如 下:
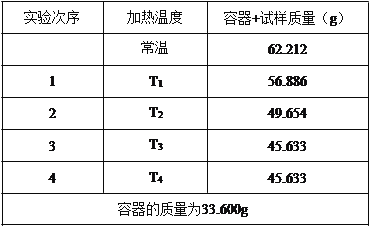
(1)该实验称量用的仪器是_____;实验记录中的容器是指_____(填仪器名字);冷却必须放在_____中进行(填仪器名称)。
(2)该学生停止实验的依据是_____。
(3)该样品中 n 的值为_____。(保留一位小数)
(4)若该实验过程中出现下列操作,其中可能会使实验结果 n的值偏大的是(______)
A.容器内壁原来附着有受热不分解的物质
B.碳酸钠晶体样品已有少量风化
C.加热后容器在空气中冷却
D.加热过程中有少量晶体溅出
(5)如果碳酸钠晶体样品不纯,测定结果(______)
A.没有偏差 B.一定偏小
C.一定偏大 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。
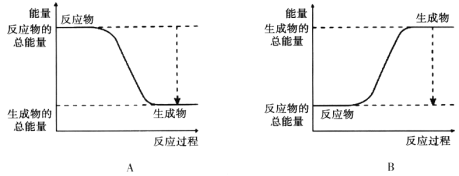
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com