
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
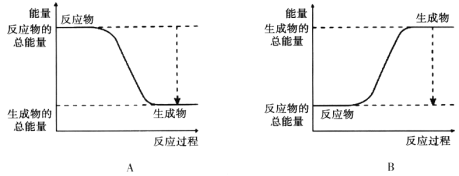
(2)下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
【答案】 ABC A 吸收热量 1368 放出热量 1850 放出热量 484 负 氧化 2.24
【解析】(1)根据外界条件对反应速率的影响分析判断;
(2)氢气燃烧是放热反应;
(3)根据断键吸热、形成化学键放热分析;
(4)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应。
(1)A.使用催化剂可以加快反应速率,A正确;
B.适当提高氧气的浓度可以加快反应速率,B正确;
C.适当提高反应的温度可以加快反应速率,C正确;
D.适当降低反应的温度减小反应速率,D错误。
答案选ABC。
(2)氢气燃烧是放热反应,这说明反应物的总能量高于生成物的总能量,因此能正确表示该反应中能量变化的是A。
(3)由于断键吸收能量,则拆开2molH2化学键需要吸收2mol×436kJ/mol=872kJ,拆开1molO2化学键需要吸收能量是1mol×496kJ/mol=496kJ,则断键共需要吸收的能量是872kJ+496kJ=1368kJ;形成4molH-O键放出的能量是4mol×463kJ/mol=1852kJ,所以2mol氢气反应最终放出的能量是1852kJ-1368kJ=484kJ。
(4)氢气在反应中失去电子,则氢气在负极通入。1mol氢气失去2mol电子,电路中每转移0.2mol电子,则消耗氢气是0.1mol,标准状况下的体积是2.24L。


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取乙酸乙酯。
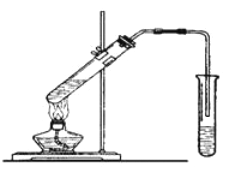
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下: _________________________,然后轻振荡使其混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是 _______________________________________________。
(3)浓硫酸的作用是:① _______________; ② ______________。
(4)图中右边试管中试剂是 _____________________________。
(5)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式______________________________________
(7)写出乙酸与碳酸氢钠反应方程式_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由 图分析不能得出的结论是( )

A. a是反应物
B. 正反应是一个体积扩大的反应
C. 若升高温度,a的转化率增大
D. 若增大压强,a的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积固定的密闭容器中发生可逆反应:A (g)+2B (g)![]() C (s)+D (g),能说明反应已达到平衡状态的事实是
C (s)+D (g),能说明反应已达到平衡状态的事实是
A. 容器内A、B、C、D四者共存 B. νA(正)=2νB(逆)
C. 容器内各种物质的浓度不再改变 D. νA(正)=νC(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
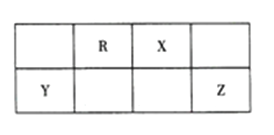
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入少量无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到乙试管中有明显现象时停止实验。试回答:

(1)试管乙中观察到的现象是______________________。
(2)液体混合加热时液体容积不能超过其容积_____,本实验反应开始时用小火加热的原因是__________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(3)试管甲中加入浓硫酸的目的是__________。
(4)该实验中长导管的作用是_______,其不宜伸入试管乙的溶液中,原因是________。
(5)试管乙中饱和Na2CO3的作用是______________________________________。
(6)写出试管甲中发生反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙葵醛是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)X的名称是_______
(2)下列有关龙葵醛和C3H6(烯烃)的说法正确的是________(填序号)。
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(3)反应⑤的试剂和条件是________,反应③的反应类型是__________。
(4)有机物T所含官能团的名称是________,反应④的化学方程式为__________。
(5)在T的同分异构体中,遇氯化铁溶液发生显色反应的有_____种,其中,在核磁共振氢谱上有4 组峰且峰的面积之比为1:2 :3 :6 的结构简式为_________(写出其中的一种)。
(6) 参照上述流程图(如R![]() X……),以2-甲基-1,3-丁二烯为原料,经三步制备2-甲基-1,4-丁二醛,设计合成路线:________________。
X……),以2-甲基-1,3-丁二烯为原料,经三步制备2-甲基-1,4-丁二醛,设计合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组
物质在水中可能存在电离平衡、盐类的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 molL-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________________。
(2)B为0.1 molL-1 NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(共3个,分别用离子方程式表示):_____________________________________________
(3)C为Al2(SO4)3溶液,实验室中配制Al2(SO4)3溶液时通常需要向其中加入_______________,若把B和C溶液混合,将产生白色沉淀和无色气体,该反应的离子方程式为___________________。
(4)pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8,反应生成的正盐的化学式为_________,盐中________离子一定能水解,其第一步水解的离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com