
【题目】800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由 图分析不能得出的结论是( )

A. a是反应物
B. 正反应是一个体积扩大的反应
C. 若升高温度,a的转化率增大
D. 若增大压强,a的转化率减小
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+![]() O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ① B. ④ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.Sic与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。

①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,相对原子质量Ga∶70,As∶75,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的结晶水合物在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体( Na 2CO3·nH2O )。为测定其组成,某同学在不同温度下加热样品(温度逐渐升高),实验结果记录如 下:
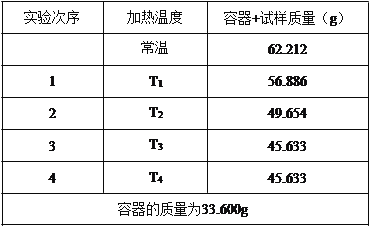
(1)该实验称量用的仪器是_____;实验记录中的容器是指_____(填仪器名字);冷却必须放在_____中进行(填仪器名称)。
(2)该学生停止实验的依据是_____。
(3)该样品中 n 的值为_____。(保留一位小数)
(4)若该实验过程中出现下列操作,其中可能会使实验结果 n的值偏大的是(______)
A.容器内壁原来附着有受热不分解的物质
B.碳酸钠晶体样品已有少量风化
C.加热后容器在空气中冷却
D.加热过程中有少量晶体溅出
(5)如果碳酸钠晶体样品不纯,测定结果(______)
A.没有偏差 B.一定偏小
C.一定偏大 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y 和 Z 的原子序数依次增大。金属元素 W 是制备一种高效电池的重要材料,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地壳中含量最丰富的金属元素,Z 原子的最外层电子 数是其电子层数的 2 倍。
(1)W 元素的原子核外共有_____种不同运动状态的电子、_____种不同能量的电子。
(2)元素 Z 与元素 X 形成共价化合物 XZ2是____(选填“极性”或“非极性”)分子,其电子式为_____。
(3)Y 原子的最外层电子排布式为_____
(4)两种非金属元素中,非金属性较强的元素是_____(写元素符号),试写出一个能说明这一事实的 化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O表示的是( )
A.NaOH溶液和H2CO3的反应B.氨水和稀H2SO4的反应
C.Ba(OH)2溶液和稀H2SO4的反应D.KOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用HCl气体“置换”除水,升华相结合的方法从市售的氯化锌制备高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl]。下列说法不正确的是

A. 恒压漏斗的作用是平衡气体压强
B. 管式炉Ⅰ采取的升温方式是阶段式升温
C. 实验时,应先撒去管式炉Ⅰ,再撤去管式炉Ⅱ
D. 在尾气吸收装置前应增加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。
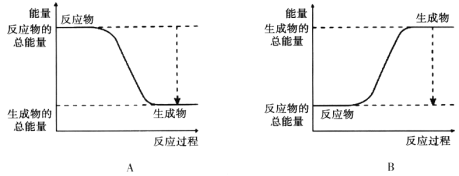
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g
B.500 mL,117 g
C.1 000 mL,117 g
D.任意规格,111.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com