
| A、HClO |
| B、H3PO4 |
| C、HNO3 |
| D、HClO4 |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1?min-1 |
| B、0.04mol?L-1?min-1 |
| C、0.2mol?L-1?min-1 |
| D、0.5mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食盐和蔗糖熔化 |
| B、金刚石和硫熔化 |
| C、碘和干冰升华 |
| D、二氧化硅和氧化钠熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2和稀盐酸反应 |
| B、Ba(OH)2溶液滴入稀H2SO4中 |
| C、KOH溶液和稀HNO3反应 |
| D、CO2通入Ca(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO?CuCl2 |
| 400℃ |
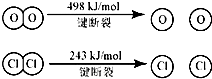
| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na |
| D、酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com