
| A、离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na |
| D、酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
| A、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 |
| D、二氧化硫可用于漂白纸浆、毛、丝等,还可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=H2++SO42- |
| B、NaHSO4=Na++HSO4- |
| C、Na2CO3=2Na++CO32- |
| D、Ca(OH)2=Ca2++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: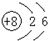 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32ˉ+2H+=CO2↑+H2O | ||||
B、用石墨作电极电解氯化镁:2Cl-+2H2O
| ||||
| C、向亚硫酸钠溶液中滴加少量的新制氯水:2SO32ˉ+Cl2+2H2O=2SO42ˉ+2Clˉ+4H+ | ||||
| D、利用氯酸钾和浓盐酸制消毒剂ClO2:2ClO3ˉ+4H++2Clˉ=2ClO2↑+Cl2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
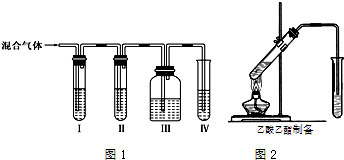
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com