
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: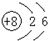 |
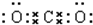 ,所以二氧化碳的结构式为:O=C=O,故A错误;
,所以二氧化碳的结构式为:O=C=O,故A错误;

 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| CuO?CuCl2 |
| 400℃ |
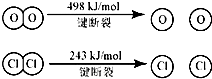
| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na |
| D、酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g CH4含有CH4分子数为NA |
| B、常温常压下,22.4L CO2含有CO2分子数为NA |
| C、1mol Na燃烧生成Na2O2失去的电子数为2NA |
| D、0.5mol?L-1的CuCl2溶液中含Cl-数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com