
| A、常温常压下,16g CH4含有CH4分子数为NA |
| B、常温常压下,22.4L CO2含有CO2分子数为NA |
| C、1mol Na燃烧生成Na2O2失去的电子数为2NA |
| D、0.5mol?L-1的CuCl2溶液中含Cl-数为NA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: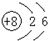 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molH2SO4的质量为98g/mol |
| B、摩尔是7个基本物理量之一 |
| C、6.02×1022个H2SO4分子的质量为9.8g |
| D、CO2的摩尔质量是44g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32ˉ+2H+=CO2↑+H2O | ||||
B、用石墨作电极电解氯化镁:2Cl-+2H2O
| ||||
| C、向亚硫酸钠溶液中滴加少量的新制氯水:2SO32ˉ+Cl2+2H2O=2SO42ˉ+2Clˉ+4H+ | ||||
| D、利用氯酸钾和浓盐酸制消毒剂ClO2:2ClO3ˉ+4H++2Clˉ=2ClO2↑+Cl2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
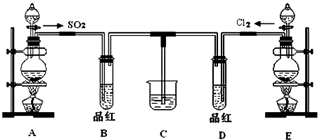
查看答案和解析>>
科目:高中化学 来源: 题型:
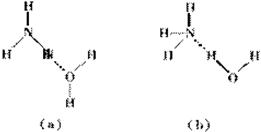 (1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式
(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com