
| CuO?CuCl2 |
| 400℃ |
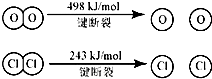
| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、原电池负极发生氧化反应 |
| B、电解池阳极发生还原反应 |
| C、通电后,电解池中阳离子向阴极移动 |
| D、原电池中电子从负极沿导线流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=H2++SO42- |
| B、NaHSO4=Na++HSO4- |
| C、Na2CO3=2Na++CO32- |
| D、Ca(OH)2=Ca2++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: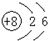 |
查看答案和解析>>
科目:高中化学 来源: 题型:
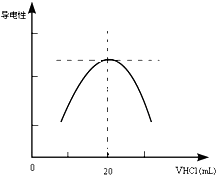 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com