
【题目】已知下列反应的能量变化示意图。
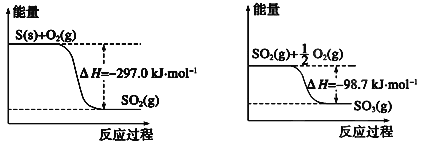
(1)1molS(g)与O2(g)完全反应生成SO2(g),反应的ΔH___-297.0kJ·mol-1(填“>”或“<”)
(2)写出S(s)与O2(g)反应生成SO3(g)的热化学方程式___。
【答案】< S(s)+![]() O2(g)=SO3(g) ΔH=-395.7kJ·mol-1
O2(g)=SO3(g) ΔH=-395.7kJ·mol-1
【解析】
(1)由左边图中可以看出,1molS(s)与O2(g)完全反应生成SO2(g),反应的ΔH=-297.0kJ·mol-1,S(g) 能量比S(s)高,则S(g)燃烧放出的能量比S(s)高。
(2)利用左、右两图分别写出两个反应的热化学方程式,然后利用盖斯定律求出S(s)与O2(g)反应生成SO3(g)的热化学方程式。
(1)由左边图中可以看出,1molS(s)与O2(g)完全反应生成SO2(g),反应的ΔH=-297.0kJ·mol-1,S(g) 能量比S(s)高,所以S(g)燃烧放出的能量比S(s)高,但由于ΔH为负值,因此1molS(g)与O2(g)完全反应生成SO2(g),反应的ΔH<-297.0kJ·mol-1。答案为:<;
(2)左、右两图表示的反应为S(s)+O2(g)=SO2(g) ΔH=-297.0kJ·mol-1,SO2(g)+![]() O2(g)
O2(g)
=SO3(g) ΔH=-98.7.0kJ·mol-1,两式相加得S(s)+![]() O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。答案为:S(s)+
O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。答案为:S(s)+![]() O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。
O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH2CH2CH3(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+
O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+![]() O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
A.正丁烷与异丁烷的能量大小关系如图
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
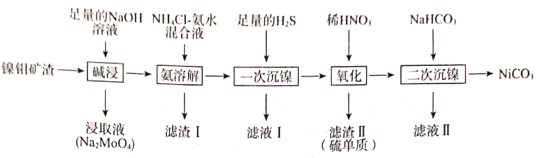
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面信息,推断元素,按要求回答问题:
信息 | 问题 |
①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是__ A.氢 B.碳 C.氧 D.硫 |
②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?__ |
③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为__ |
④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为__ |
⑤X与W同主族 | (5)X的最高价氧化物的电子式为___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
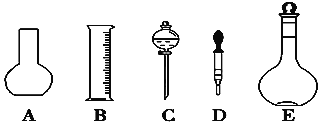
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液 E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.3 mol/L(填“大于”“等于”或“小于”,下同)。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________ mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为
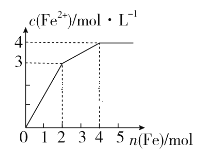
A.3∶1B.1∶2C.2∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列说法正确的是
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com