

 2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 KIO3 + 3H2↑。下列说法中正确的是
KIO3 + 3H2↑。下列说法中正确的是 | A.电解时石墨作阴极 |
| B.电解时阳极上产生H2 |
| C.电解过程中阴极区溶液pH升高 |
| D.阴极电极反应式:I-- 6e-+ 3H2O = IO3-+ 6H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

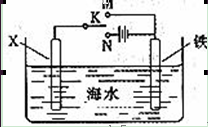
查看答案和解析>>
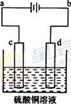
科目:高中化学 来源:不详 题型:单选题
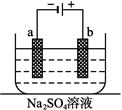
| A.a电极附近呈红色,b电极附近呈蓝色 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.逸出气体的体积,a电极的大于b电极的 |
| D.a、b两电极都逸出无色无味气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
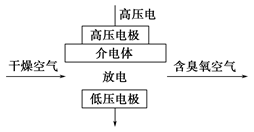
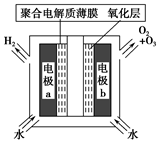
A.高压放电法,反应的原理为3O2 2O3 2O3 |
| B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物 |
| C.电解时,电极b周围发生的电极反应有3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+ |
| D.电解时,H+由电极a经聚合固体电解质膜流向电极b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
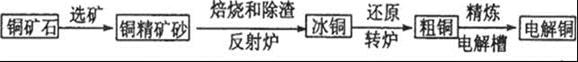
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.乙中左侧电极反应式:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
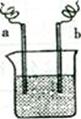
| A.该装置可能是电解池 |
| B.a极上发生的是还原反应 |
| C.a、b不可能是同种电极材料 |
| D.该装置工作时,溶液中的阴离子向b极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com