
25 ℃时,相同物质的量浓度的下列溶液:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
一定温度下,向0.1 mol·L-1CH3COOH溶液中加少量水,下列有关说法错误的是
A.溶液中所有离子的浓度都减小
B.CH3COOH的电离程度变大
C.水的电离程度变大
D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【实验探究】 在实验室完成如下实验,并回答以下问题。在锥形瓶内装入10mL 1mol / L的A1C13溶液,逐滴滴人3 mol / L的NaOH溶液至过量,边滴边摇晃锥形瓶。
(1) 请描述实验现象
(2) 开始发生反应的化学方程式:
加入过量NaOH溶液后发生的反应的离子方程式:
(3) 生成沉淀物的最大质量是
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-a mol· L-1和1.0×10-b mol·L-1,在此温度下,则下列说法正确的是
A.a<b
B.a=b
C.水的离子积为1.0×10-(7+a)
D.水的离子积为1.0×10-(b+a)
查看答案和解析>>
科目:高中化学 来源: 题型:
在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
| 序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.1 B.4
C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为_____________________________________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________________________________________________________________________;
(4)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
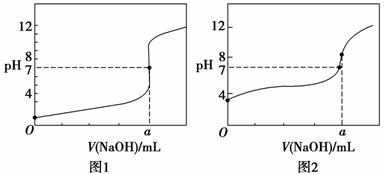
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a= ________ mL。
________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性气味、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是( )
A.一定有SO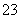 离子
离子
B.一定有CO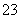 离子
离子
C.不能确定Cl-离子是否存在
D.不能确定HCO 离子是否存在
离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.2 mol·L-1H2SO3溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示。(其中Ⅰ表示H2SO3,Ⅱ代表HSO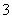 、Ⅲ代表SO
、Ⅲ代表SO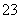 )。根据图示判断正确的是
)。根据图示判断正确的是
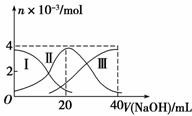
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-7
B.当V(NaOH)=20 mL时:c(Na+)>c(HSO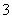 )>c(H+)>c(SO
)>c(H+)>c(SO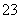 )>c(OH-)
)>c(OH-)
C.当V(NaOH)=40 mL时2c(Na+)=c(SO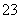 )
)
D.当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com