
【题目】室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1mol·L-1Na2CO3溶液中,加水稀释,![]() 的值减小
的值减小
B.0.1mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
C.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
【答案】B
【解析】
A. 0.1mol·L-1Na2CO3溶液中,加水稀释,c(OH-)减小,![]() 不变,所以
不变,所以![]() 值增大,故A错误;
值增大,故A错误;
B. 0.1mol·L-1的硫酸铝溶液中,铝离子水解,溶液呈酸性,所以c(SO42-)>c(Al3+)>c(H+)>c(OH-),故B正确;
C. pH=7的氨水与氯化铵的混合溶液c(H+)=c(OH-),根据电荷守恒c(Cl-)+ c(OH-) =c(NH4+)+ c(H+),所以c(Cl-)=c(NH4+),故C错误;
D. 醋酸是弱电解质,pH=2的醋酸溶液的浓度大于pH=12的NaOH溶液,等体积的溶液中醋酸物质的量大于氢氧化钠,所以c(Na+)<c(CH3COO-)+c(CH3COOH),故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
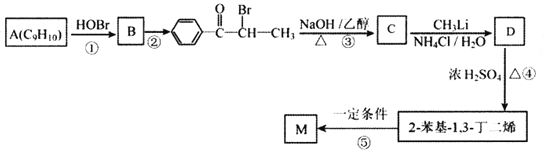
【题目】M(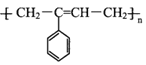 )是一种高分子化合物,它的合成路线如图所示:
)是一种高分子化合物,它的合成路线如图所示:
已知:①R-CH=CH2![]() R-CH(OH)CH2Br
R-CH(OH)CH2Br
②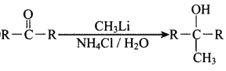
回答下列问题:
(1)反应①的反应类型为__________,D中的官能团名称是__________。
(2)A的名称是__________(系统命名法)。
(3)反应②的条件为__________;反应③的化学方程式为__________。
(4)H为B的同分异构体,满足下列条件的结构共有__________种(不含立体异构);其中核磁共振氢谱中出现4组峰,且峰面积之比为6:2:2:1的是__________ (写出结构简式)。
i.苯环上有两个取代基;ⅱ.与FeCl3溶液发生显色反应。
(5)参照上述合成路线,以![]() 为原料(其他原料任选)制备
为原料(其他原料任选)制备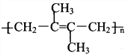 ,请设计合成路线__________。
,请设计合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
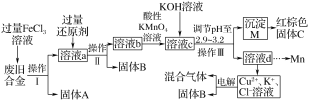
已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途____________________(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知浓硝酸和乙胺反应:![]() ,产物
,产物![]() 的熔点为
的熔点为![]() ,在室温下能够融化电离出
,在室温下能够融化电离出![]() 和
和![]() 离子,称为室温离子.下列有关正确的是
离子,称为室温离子.下列有关正确的是![]()
A.浓硝酸和乙胺反应属于加成反应
B.室溫离子可以使熔盐燃料电池在常溫下工作
C.![]() 中,只有
中,只有![]() 键没有
键没有![]() 键
键
D.融化![]() 晶体需要破坏分子间作用力
晶体需要破坏分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)![]() CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。

①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的____点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________0(填“>”“<”或“=”),理由是______________;当压强为p2时,在y点:v正________v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
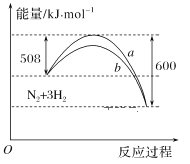
A.在温度、体积一定的条件下,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2molN2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
B.该反应的热化学方程式为:N2+3H22NH3 ΔH=-92kJ·mol-1
C.a曲线是加入催化剂时的能量变化曲线
D.加入催化剂,该化学反应的反应热改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列五种元素的电离能数据![]() 单位:
单位:![]() ,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
,它们的最高价氧化物对应的水化物中,碱性最弱的是( )
元素代号 |
|
|
|
|
A | 420 | 3100 | 4400 | 5900 |
B | 500 | 4600 | 6900 | 9500 |
C | 740 | 1500 | 7700 | 10500 |
D | 580 | 1800 | 2700 | 11600 |
E | 2080 | 4000 | 6100 | 9400 |
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com