
【题目】玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
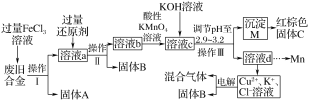
已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途____________________(答一条即可)。
【答案】过滤 Si 2Fe3++Cu===2Fe2++Cu2+ Fe3+ MnO4-+5Fe2+ +8H+===Mn2++5Fe3++4H2O Mn(OH)2 涂料等
【解析】
含有Cu、Fe、Si废旧合金中的铁与铜与过量的氯化铁溶液发生氧化还反应,得到固体硅和含氯化铜、氯化亚铁和氯化铁的混合溶液a,加入过量的还原剂铜粉,得到时氯化亚铁和氯化铜的混合溶液b,然后向溶液中加入酸性高锰酸钾将亚铁离子氧化成铁离子,得到含锰离子、铁离子和铜离子的混合溶液中滴加氢氧化钾调节溶液的pH使铁离子完全沉淀,然后过滤得到氢氧化铁固体,灼烧得到氧化铁,以此解答该题。
(1)通过操作Ⅰ、Ⅱ、Ⅲ都得到固体和溶液,所用该操作是过滤,过滤是把不溶性固体和溶液分开的操作,含有Cu、Fe、Si废旧合金中的铁与铜与过量的氯化铁溶液发生氧化还反应,得到固体硅和含氯化铜、氯化亚铁和氯化铁的混合溶液a,
故答案为:过滤;Si;
(2)合金中含有铜,可与氯化铁反应,加人过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+,
故答案为:2Fe3++Cu===2Fe2++Cu2+;
(3)因Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,溶度积常数越小,对应离子越易沉淀,所以沉淀顺序为:Fe3+>Cu2+>Mn2+,使氯化铁完全生成氢氧化铁,故答案为:Fe3+;
(4)溶液b中含亚铁离子,会被酸性高锰酸钾氧化成铁离子,高锰酸钾被还原为锰离子,反应的离子方程式为MnO4-+5Fe2+ +8H+===Mn2++5Fe3++4H2O ,
故答案为:MnO4-+5Fe2+ +8H+===Mn2++5Fe3++4H2O ;
(5)因Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,溶度积常数越小,对应离子越易沉淀,故沉淀顺序为:Fe3+>Cu2+>Mn2+,则最后得到Mn(OH)2
故答案为:Mn(OH)2;
(6)红棕色固体C是氧化铁,用途是油漆,涂料,
故答案为:涂料。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】已知A和B反应的化学方程式为A(g)+2B(g)![]() C(g)。回答下列问题:
C(g)。回答下列问题:
(1)图1是反应A(g)+2B(g)![]() C(g)在不同温度下A的转化率随时间变化的曲线。
C(g)在不同温度下A的转化率随时间变化的曲线。
①该反应的H________(填“>”“<”或“=”)0。
②在T1温度下,向体积为1 L的密闭容器中,充入1 mol A(g)和2 mol B(g),测得A(g)和C(g)的浓度随时间变化如图2所示。则10 min内C的生成速率为________________。
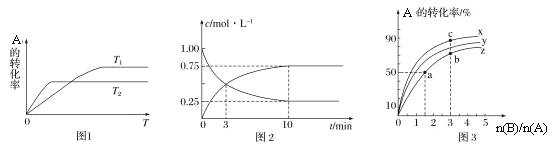
③若容器容积不变,下列措施可增加A转化率的是________(填字母)。
a.升高温度 b.将C(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容密闭容器中,分别研究在230°C、250°C和270°C条件下的上述反应。三种温度下B与A的物质的量之比与A平衡转化率的关系如图3所示。曲线z对应的温度是________°C。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,请完成下列填空:
(1)配制100mL 0.10mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)___→洗涤(并将洗涤液移入容量瓶)→___→____→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________g氢氧化钠固体,所需仪器有:天平(带砝码、镊子)、_______、________。
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成后,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.64 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
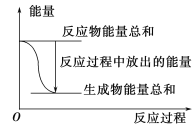
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g) ![]() CO2(g) ΔH=-437.3 kJ·mol-1;2CO(g)+ O2(g)
CO2(g) ΔH=-437.3 kJ·mol-1;2CO(g)+ O2(g) ![]() 2CO2(g) ΔH=-566.0 kJ·mol-1
2CO2(g) ΔH=-566.0 kJ·mol-1
(1)一氧化碳的标准燃烧热ΔH为:_________
(2)碳和氧气反应生成一氧化碳的热化学方程式是:___________
(3)反应CO2(g) + C(s)![]() 2CO(g) ΔH为:_________________
2CO(g) ΔH为:_________________
(4)完全燃烧相同物质的量的C和CO,放出的热量_____多(填C或CO)
(5)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式________
(6)一定条件下,在水溶液中1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图 所示。B→A+C反应的热化学方程式为(用离子符号表示)___________
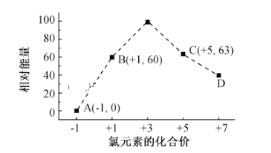
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH4+和[Cu(NH3)4]2+中都存在配位键
B.  σ键和π键比例为7:1
σ键和π键比例为7:1
C. ![]() 与
与![]() 互为等电子体,1 mol
互为等电子体,1 mol ![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1mol·L-1Na2CO3溶液中,加水稀释,![]() 的值减小
的值减小
B.0.1mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
C.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中![]() 键与
键与![]() 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
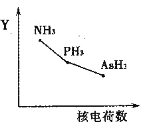
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
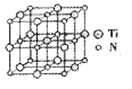
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关叙述正确的是( )
A.已知氢气和氯气在混合光照时发生爆炸,而氢气在氯气中点燃能安静燃烧,说明在同温同压下,H2(g) + Cl2(g) ═ 2HCl(g)反应条件不同,△H不同
B.将锌片直接放入足量稀硫酸中,另取同样的锌片与铜片用导线连接后再放入足量的稀硫酸中,充分反应后,两者放出的热量相同
C.NH4F溶液不能存放于玻璃试剂瓶中
D.某放热反应能自发进行,因此该反应是熵增反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com