
【题目】实验室中有一未知浓度的稀盐酸,请完成下列填空:
(1)配制100mL 0.10mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)___→洗涤(并将洗涤液移入容量瓶)→___→____→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________g氢氧化钠固体,所需仪器有:天平(带砝码、镊子)、_______、________。
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成后,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.64 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
【答案】移液 定容 摇匀 0.4 小烧杯 药匙 当滴入最后一滴NaOH溶液时,颜色由无色变为浅红色,且半分钟内不褪色 0.11mol/L 丙 D
【解析】
(1)①配制100mL 0.10mol·L-1NaOH标准溶液的主要操作步骤是计算→称量→溶解→(冷却后) 移液→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签;
②依据m=nM计算氢氧化钠的质量;称取氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯;
(2)①滴加2~3滴酚酞溶液作指示剂,当最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为浅红色,且半分钟内颜色不再改变,说明达到终点;
②根据c(酸)×V(酸)=c(碱)×V(碱)计算可得;
③碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
④分析不当操作对V(标准)的影响,以此判断浓度的误差。
(1)①配制100mL 0.10mol·L-1NaOH标准溶液的主要操作步骤是计算→称量→溶解→(冷却后) 移液→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签;
②氢氧化钠的质量为m=nM=0.10L×0.10mol/L×40g/mol=0.4g;称取氢氧化钠固体所需仪器有天平(带砝码、镊子)、小烧杯、药匙;
(2)①滴加2~3滴酚酞溶液作指示剂,当最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为浅红色,且半分钟内颜色不再改变,说明达到终点;
②由表格数据可知,三次实验消耗氢氧化钠溶液的体积为![]() =22.72mL,根据c(酸)×V(酸)=c(碱)×V(碱)可得关系式0.002272L×0.10mol/L=0.0020000L×c(HCl),解得c(HCl)≈0.11mol/L;
=22.72mL,根据c(酸)×V(酸)=c(碱)×V(碱)可得关系式0.002272L×0.10mol/L=0.0020000L×c(HCl),解得c(HCl)≈0.11mol/L;
③碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
④A、滴定到达终点时,俯视读出滴定管读数,会导致NaOH溶液体积偏小,测定溶液浓度偏小,故A错误;
B、酸式滴定管水洗后未用待测稀盐酸溶液润洗,会导致盐酸溶液中氯化氢的物质的量偏小,消耗NaOH体积偏小,测定溶液浓度偏小,故B错误;
C、锥形瓶水洗后未干燥,盐酸溶液中氯化氢的物质的量不变,对实验无影响,待测液浓度准确,故C错误;
D、碱式滴定管尖嘴部分有气泡,滴定后消失,会导致NaOH溶液体积偏大,测定溶液浓度偏大,故D正确;
故答案为:D。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】研究电化学原理与应用有非常量要的意义。
(1)锌锰电池(俗称干电池)是一种一次电池,生活中应用广泛。若锌锰电池工作环境为酸性,则此时负极上的电极反应式为:___。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①放电时正极反应为(离子方程式):___。
②铅蓄电池放电时,当消耗了10.35gPb时,转移的电子的物质的量为___。
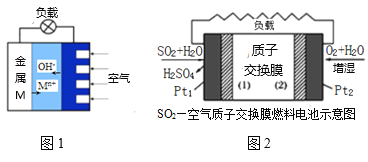
(3)如图1是金属(M)—空气电池的工作原理,我国首创的海洋电池以铅板为负极,铂网为正极,海水为电解质溶液,则该电池反应方程式为:___。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示,则Pt2上的电极反应式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是![]()
A.长期使用![]() 化肥会使土壤酸化,而过度使用尿素
化肥会使土壤酸化,而过度使用尿素![]() 会使土壤碱化
会使土壤碱化
B.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
C.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质
D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述不正确的是

A. 分子式为C9H9O4Br
B. 在一定条件下可与HCHO发生缩聚反应
C. 1 mol该物质与足量NaOH溶液混合加热,最多能消耗4mol NaOH
D. 1 mol该物质与浓溴水反应,最多能消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
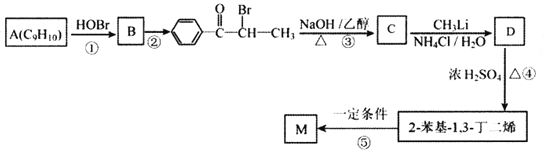
【题目】M(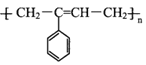 )是一种高分子化合物,它的合成路线如图所示:
)是一种高分子化合物,它的合成路线如图所示:
已知:①R-CH=CH2![]() R-CH(OH)CH2Br
R-CH(OH)CH2Br
②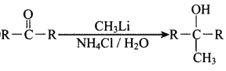
回答下列问题:
(1)反应①的反应类型为__________,D中的官能团名称是__________。
(2)A的名称是__________(系统命名法)。
(3)反应②的条件为__________;反应③的化学方程式为__________。
(4)H为B的同分异构体,满足下列条件的结构共有__________种(不含立体异构);其中核磁共振氢谱中出现4组峰,且峰面积之比为6:2:2:1的是__________ (写出结构简式)。
i.苯环上有两个取代基;ⅱ.与FeCl3溶液发生显色反应。
(5)参照上述合成路线,以![]() 为原料(其他原料任选)制备
为原料(其他原料任选)制备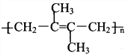 ,请设计合成路线__________。
,请设计合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
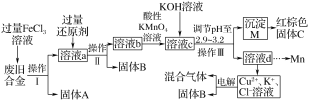
已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途____________________(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
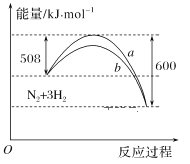
A.在温度、体积一定的条件下,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2molN2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
B.该反应的热化学方程式为:N2+3H22NH3 ΔH=-92kJ·mol-1
C.a曲线是加入催化剂时的能量变化曲线
D.加入催化剂,该化学反应的反应热改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com