
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO—+4OH— =2FeO42— +3Cl— +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是( )
A.高铁酸钠中铁显+6价 B.湿法中FeO42—是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
科目:高中化学 来源: 题型:
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应是一类重要的化学反应,广泛存在于自然界中,对人们的生产、生活有着十分重要的作用。你认为下列对氧化还原反应的描述不正确的是( )。
A.肯定有电子转移
B.肯定是有关氧元素的反应
C.肯定有元素化合价的变化
D.氧化剂得到电子的总数与还原剂失去电子的总数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B、需要通过化学反应才能从海水中获得食盐和淡水
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品
D、粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为含有同一种元素的a、b、c、d、e五种物质的转化关系。其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是( )
①C ②N2 ③S ④F2
A.只有①和③ B.只有④ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
A+B→X+Y+ H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是
.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则向A中逐滴加入B[i]的离子方程式
.
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH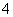 、I-、NO
、I-、NO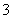
B.加入铝粉生成H2的溶液:K+、Mg2+、SO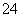 、HCO
、HCO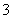
C.c(Fe3+)=0.1mol·L-1的溶液:H+、Al3+、I-、SCN-
D.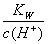 =0.1mol·L-1的溶液:Na+、K+、SiO
=0.1mol·L-1的溶液:Na+、K+、SiO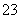 、NO
、NO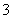
查看答案和解析>>
科目:高中化学 来源: 题型:
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图K39-4:

图K39-4
(1)向沉淀池中要通入CO2和氨气,应选通入______ (填化学式)。原因是_________________________________________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________ 。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据部分短周期元素的原子半径及主要化合价信息,判断以下叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、—2 | —2 |
A.氢化物的沸点为H2T<H2R B.金属性强弱:L<Q
C.M与T形成的化合物的化学式是Al2O3 D.L2+与R2-的核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com