
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水中后有1.16g白色沉淀,在所得的悬独液中逐滴加入1mol·L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示。试回答:

(1)A点沉淀物的化学式为_____________,A点熔液中的溶质是___________________;B点沉淀物的化学式为____________________。
(2)原混合物中MgCl2的物质的量为________________,AlCl3的物质的量为__________,NaOH的物质的量为________________。
(3)HCl溶液在Q点的加入量是____________________。
【答案】 Mg(OH)2 NaCl、NaAlO2 Mg(OH)2、Al(OH)3 0.02mol 0.02mol 0.13mol 130mL
【解析】在所得悬浊液中加入加入盐酸,0-A段沉淀的质量没有改变,说明发生反应为:OH-+H+= H2O,可推段NaOH、MgCl2、AlCl3组成的混合物溶于水,反应后,溶液中NaOH过量,此时溶液中Al3+已转化为AlO2-,1.16g白色沉淀应为Mg(OH)2;A-B段,随着盐酸的加入,沉淀的质量开始增加,应发生反应:AlO2-+H++H2O= Al(OH)3↓;B-Q段,沉淀逐渐溶解。
(1)根据上述分析,O点的溶质为:NaOH、NaAlO2,沉淀为Mg(OH)2;A点的溶质为:NaCl、NaAlO2,沉淀为Mg(OH)2;B点溶质为NaCl,沉淀为Mg(OH)2、Al(OH)3;Q点溶质为:NaCl、MgCl2、AlCl3。故答案为:Mg(OH)2;NaCl、NaAlO2;Mg(OH)2、Al(OH)3。
(2)1.16g白色沉淀应为Mg(OH)2,则Mg(OH)2的物质的量为![]() 。根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol;A-B段消耗20mL盐酸,反应为:H2O+AlO2-+H+= Al(OH)3↓,根据n (AlCl3)=n(AlO2-)=n(HCl)=1mol/L×0.02L=0.02mol;B点溶质为NaCl,根据Na原子守恒可知,n(NaOH)=n(NaCl),而Cl-来自于盐酸、MgCl2、AlCl3。O点到B点共加入30mL盐酸,所以n(NaCl)= 1mol/L×0.03L+ n(MgCl2) ×2+ n (AlCl3) ×3=0.13mol,故n(NaOH)=0.13mol;
。根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol;A-B段消耗20mL盐酸,反应为:H2O+AlO2-+H+= Al(OH)3↓,根据n (AlCl3)=n(AlO2-)=n(HCl)=1mol/L×0.02L=0.02mol;B点溶质为NaCl,根据Na原子守恒可知,n(NaOH)=n(NaCl),而Cl-来自于盐酸、MgCl2、AlCl3。O点到B点共加入30mL盐酸,所以n(NaCl)= 1mol/L×0.03L+ n(MgCl2) ×2+ n (AlCl3) ×3=0.13mol,故n(NaOH)=0.13mol;
故答案为:0.02mol;0.02mol;0.13mol;
(3)B-Q段,Mg(OH)2、Al(OH)3逐渐溶解,生成MgCl2、AlCl3,此段消耗HCl物质的量应等于n(MgCl2) ×2+ n (AlCl3)=0.1mol,盐酸浓度为1mol·L-1,则B-Q段消耗盐酸0.1L,即100mL,O-B段共消耗盐酸30mL,HCl溶液在Q点的加入总量为130mL。
故答案为:130mL。


科目:高中化学 来源: 题型:
【题目】A为ⅡA主族元素,B为ⅢA主族元素,A、B同周期,其原子序数分别为M,N,甲乙为同一主族相邻元素,其原子序数分别为X、Y。则下列选项中的两个关系式均正确的是:
A. N=M+10 Y=X+2 B. N=M+11 Y=X+4 C. N=M+25 Y=X+8 D. N=M+10 Y=X+18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔物理学奖曾授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A. 二氧化硅是酸性氧化物,因此能与水反应生成硅酸
B. 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅
C. 二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆
D. 二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥食物腐败
A.②③④⑤⑥B.②③④C.②⑤⑥D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如右图所示。下列判断不正确的是

A. 在0-50min之间,pH=2和pH =7时H2O2的分解百分率相等
B. 溶液酸性越强,H2O2的分解速率越大
C. 相同条件下,H2O2的起始浓度越小,分解速率越大
D. 在20—25 min之间,pH=10时H2O2的平均分解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去)。
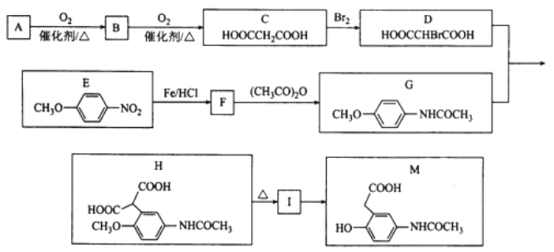
已知:①A的密度是相同条件下H2密度的38倍,其分子的核磁共振氢谱中有3组峰;
②![]()
请回答下列问题:
(1)A的结构简式为___________________,M的分子式为_____________________。
(2)G+D→H的化学方程式为___________________________。
(3)H不可能发生的反应为_______________(填编号)。
A.加成反应 B.氧化反应 C.取代反应 D.消去反应
(4)同时满足下列条件的E的同分异构体有_________________种。
①能与FeCl3溶液发生显色反应
②能与NaHCO3反应
③含有—NH2
④苯环上有处于对位的取代基
(5)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )

A. Na2O2中阴阳离子数目之比为1∶1
B. 反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
D. 反应③转移电子的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,

则原溶液中Cl-与SO42-的物质的量之比为
A.1:3 B.1:6 C.3:2 D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com