
ЎѕМвДїЎїИзНјЛщКѕЈ¬БЅФІИ¦ПаЅ»µДІї·Ц±нКѕФІИ¦ДЪµДОпЦКП໥·ўЙъµД·ґУ¦ЎЈТСЦЄДЖј°ЖдСх»ЇОпµДОпЦКµДБїѕщОЄ0.1 molЈ¬Л®µДЦКБїОЄ100 gЎЈПВБРЛµ·ЁХэИ·µДКЗ(ЎЎЎЎ)

A. Na2O2ЦРТхСфАлЧУКэДїЦ®±ИОЄ1ЎГ1
B. ·ґУ¦ўЩµДАлЧУ·ЅіМКЅОЄNaЈ«2H2O===NaЈ«Ј«2OHЈЈ«H2Ўь
C. ўЩЎўўЪЎўўЫід·Ц·ґУ¦єуЛщµГИЬТєЦРИЬЦКµДЦКБї·ЦКэЈєўЩ>ўЪ>ўЫ
D. ·ґУ¦ўЫЧЄТЖµзЧУµДОпЦКµДБїОЄ0.1mol
Ўѕґр°ёЎїD
ЎѕЅвОцЎїAЎў№эСх»ЇДЖЦРТхАлЧУКЗO22-Ј¬ЛщТФТхСфАлЧУКэДїЦ®±ИОЄ1Јє2Ј¬AґнОуЈ»BЎў·ґУ¦ўЩµДАлЧУ·ЅіМКЅОЄЈє2NaЈ«2H2O=2NaЈ«Ј«2OHЈЈ«H2ЎьЈ¬BґнОуЈ»CЎўДЖЎўСх»ЇДЖЎў№эСх»ЇДЖєНЛ®·ґУ¦µД·ЅіМКЅ·Ц±рИзПВЈє
Na+H2O=NaOH+1/2H2ЎьЈ¬ИЬТєФцјУµДЦКБї=mЈЁNaЈ©-mЈЁH2Ј©=2.3g-0.1g=2.2gЈ»
Na2O+H2O=2NaOHЈ¬ИЬТєФцјУµДЦКБї=mЈЁNa2OЈ©=0.1molЎБ62g/mol=6.2gЈ»
Na2O2+H2O=2NaOH+1/2O2ЎьЈ¬ИЬТєФцјУµДЦКБї=mЈЁNa2O2Ј©-mЈЁO2Ј©=6.2gЈ»
ЛщТФИЬТєФцјУµДЦКБїґуРЎЛіРтОЄЈєДЖЈјСх»ЇДЖ=№эСх»ЇДЖЈ¬ёщѕЭДЖФЧУКШєгЦЄЈ¬0.1molµДДЖЎўСх»ЇДЖЎў№эСх»ЇДЖИЬУЪЛ®ЛщµГЗвСх»ЇДЖµДОпЦКµДБї·Ц±рОЄЈє0.1molЎў0.2molЎў0.2molЈ¬НЁ№эТФЙП·ЦОцїЙЦЄЈ¬0.1molµДДЖЎўСх»ЇДЖЎў№эСх»ЇДЖ·Ц±рИЬУЪЛ®ЛщµГИЬТєµДЦКБї·ЦКэ·Ц±рОЄЈє4g/102.2gЎў8g/106.2gЎў8g/106.2gЈ¬ЛщТФўЩЎўўЪЎўўЫід·Ц·ґУ¦єуЛщµГИЬТєµДЦКБї·ЦКэґУґуµЅРЎЈєўЩЈјўЪ=ўЫЈ¬CґнОуЈ»DЎў·ґУ¦·ЅіМКЅОЄЈє
2Na2O2+2H2O=4NaOH+O2Ўь
2mol 1mol
0.1mol 0.05mol
1mol№эСх»ЇДЖІОУл·ґУ¦ЧЄТЖ1molµзЧУЈ¬ЛщТФ·ґУ¦ўЫЧЄТЖµзЧУµДОпЦКµДБїОЄ0.1molЈ¬DХэИ·Ј»ґр°ёСЎDЎЈ


 ЧЦґКѕдЖЄУлН¬ІЅЧчОДґп±кПµБРґр°ё
ЧЦґКѕдЖЄУлН¬ІЅЧчОДґп±кПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУлNO3-»ҐОЄµИµзЧУМеµДКЗ (ЎЎ )
A.SO3B.SO2C.CH4D.NO2
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї°СNaOHЎўMgCl2ЎўAlCl3ИэЦЦ№ММеЧйіЙµД»мєПОпИЬУЪЧгБїЛ®ЦРєуУР1.16g°ЧЙ«іБµн,ФЪЛщµГµДРь¶АТєЦРЦрµОјУИл1molЎ¤L-1HClИЬТє,јУИлHClИЬТєµДМе»эVУлЙъіЙіБµнµДЦКБїmµД№ШПµИзНјЛщКѕЎЈКФ»ШґрЈє

ЈЁ1Ј©AµгіБµнОпµД»ЇС§КЅОЄ_____________Ј¬AµгИЫТєЦРµДИЬЦККЗ___________________Ј»BµгіБµнОпµД»ЇС§КЅОЄ____________________ЎЈ
ЈЁ2Ј©Ф»мєПОпЦРMgCl2µДОпЦКµДБїОЄ________________,AlCl3µДОпЦКµДБїОЄ__________,NaOHµДОпЦКµДБїОЄ________________ЎЈ
ЈЁ3Ј©HClИЬТєФЪQµгµДјУИлБїКЗ____________________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРУР№ШУР»ъОпµДЛµ·ЁХэИ·µДКЗ
A. ИэЦЦУР»ъ»ЇєПОпЈє±ыП©ЎўВИТТП©Ўў±ЅЈ¬Жд·ЦЧУДЪЛщУРФЧУѕщФЪН¬Т»ЖЅГжЙП
B. УР»ъОп![]() µД·ЦЧУКЅКЗC10H18O
µД·ЦЧУКЅКЗC10H18O
C. ПаН¬МхјюПВЈ¬РВОмНйЎўТмОмНйЎўХэ¶ЎНйµД·РµгТАґОФцґу
D. УЙ1-де±ыНйЛ®ЅвЦЖ1-±ыґјЈ»УЙ±ыП©УлЛ®·ґУ¦ЦЖ±ыґјЈ¬КфУЪН¬Т»·ґУ¦АаРН
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБР·ЦЧУЦРЛщУРФЧУ¶јВъЧгЧоНвІгОЄ8µзЧУЅб№№µДКЗ
AЈ®CCl4 BЈ®H2O CЈ®BF3 DЈ®PCl5
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїБРКµСйІЩЧчДЬґпµЅКµСйДїµДµДКЗЈЁ Ј©
КµСйДїµД | КµСйІЩЧч | |
A | ±ИЅПЛ®єНТТґјЦРЗвµД»оЖГРФ | ·Ц±рЅ«ЙЩБїДЖН¶ИлµЅКўУРЛ®єНТТґјµДЙХ±ЦР |
B | ЕдЦЖПЎБтЛб | ПИЅ«ЕЁБтЛбјУИлЙХ±ЦРЈ¬єуµ№ИлХфБуЛ® |
C | іэИҐCu·ЫЦР»мУРµДCuO | јУИлПЎПхЛбИЬТєЈ¬№эВЛЎўПґµУЎўёЙФп |
D | Ц¤ГчSO2ѕЯУРЖЇ°ЧРФ | °СSO2НЁИлЧПЙ«КЇИпКФТєЦР |
A. A B. B C. C D. D
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЅсДкОТ№ъРВЅ®Вкєю·ўПЦґўБїґп12ТЪ¶ЦµДґуРНУНМпЎЈКЇУНµД·ЦБуІъОпЦРГ»УРµДКЗ
A. ЖыУН B. ѕЖѕ« C. ГєУН D. КЇАЇ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄ·ґУ¦Јє2X(g)+Y(g)![]() 2Z(g)ЎЈДіСРѕїРЎЧйЅ«4 mol XєН2 mol YЦГУЪТ»ИЭ»эІ»±дµДГЬ±ХИЭЖчЦРЈ¬Ів¶ЁІ»Н¬К±јд¶ОДЪXµДЧЄ»ЇВКЈ¬µГµЅИзПВ±нКэѕЭЈє
2Z(g)ЎЈДіСРѕїРЎЧйЅ«4 mol XєН2 mol YЦГУЪТ»ИЭ»эІ»±дµДГЬ±ХИЭЖчЦРЈ¬Ів¶ЁІ»Н¬К±јд¶ОДЪXµДЧЄ»ЇВКЈ¬µГµЅИзПВ±нКэѕЭЈє
tЈЁminЈ© | 2 | 4.5 | 5 | 6 |
XЧЄ»ЇВК | 30ЈҐ | 40ЈҐ | 70ЈҐ | 70ЈҐ |
ёщѕЭТФЙПРЕПўЧчіцµДПВБРЕР¶ПЦРХэИ·µДКЗЈЁ Ј©
A. ЛжЧЕ·ґУ¦µДЅшРРЈ¬»мєПЖшМеµДГЬ¶ИІ»¶ПФцґу
B. ·ґУ¦ФЪ5.5 minК±Ј¬vХэ(X)=vДж(Z)
C. 6 minК±Ј¬ИЭЖчЦРКЈУа1.4 mol Y
D. YµДЧЄ»ЇВКРЎУЪ70ЈҐ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіЖшМ¬МюAФЪ±кЧјЧґїцПВµДГЬ¶ИОЄ1.25g/LЈ¬ЖдІъБїїЙТФУГАґєвБїТ»ёц№ъјТµДКЇУН»Ї№¤·ўХ№Л®ЖЅЎЈBєНD¶јКЗЙъ»оЦРіЈјыµДУР»ъОпЈ¬DДЬёъМјЛбЗвДЖ·ґУ¦Ј¬FУРПгО¶ЎЈЛьГЗЦ®јдµДЧЄ»Ї№ШПµИзПВНјЛщКѕЈє

ЈЁ1Ј©AµДЅб№№јтКЅОЄ_____Ј¬BЦР№ЩДЬНЕµДµзЧУКЅОЄ____Ј¬DЦР№ЩДЬНЕµДГыіЖОЄ_________ЎЈ
ЈЁ2Ј©·ґУ¦ўЩµД·ґУ¦АаРНКЗ________Ј¬·ґУ¦ўЫµД»ЇС§·ЅіМКЅОЄЈє_______________ЎЈ
ЈЁ3Ј©·ґУ¦ўЪФЪCuЧцґЯ»ЇјБµДМхјюПВЅшРРЈ¬ёГКµСйµДІЅЦиКЗЅ«ємББµДНЛїЦГУЪѕЖѕ«µЖЙПјУИИЈ¬
ґэНЛї±дОЄєЪЙ«К±Ј¬СёЛЩЅ«ЖдІеИлµЅЧ°УРBµДКФ№ЬЦРЈЁИзНјЛщКѕЈ©ЎЈЦШёґІЩЧч2-3ґОЈ¬№ЫІмµЅµДПЦПуКЗ__________________________________________ЎЈёГ·ґУ¦µД»ЇС§·ЅіМКЅОЄ_____________ЎЈ

ЈЁ4Ј©DУлМјЛбЗвДЖИЬТє·ґУ¦µДАлЧУ·ЅіМКЅОЄ______________________________ЎЈ
ЈЁ5Ј©BЎўDФЪЕЁБтЛбµДЧчУГПВКµПЦ·ґУ¦ўЬЈ¬КµСйЧ°ЦГИзПВНјЛщКѕЈє
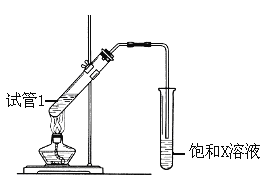
НјЦРXµД»ЇС§КЅОЄ_________ЎЈЕЁБтЛбµДЧчУГКЗ__________ЎЈ
ёГ·ґУ¦µД»ЇС§·ЅіМКЅОЄ_____________________________ЎЈ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com