
【题目】一定温度下,向一个容积为2 L的真空密闭容器中通入1 mol N2和3 mol H2,3 min后,测得容器内的压强是开始时的0.9倍,则这段时间内v(H2)为
A.0.2 mol/(L·min) B.0.6 mol/(L·min) C.0.1 mol/(L·min) D.0.3 mol/(L·min)
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易水解,易被氧化。某研究小组设计SnSO4制备路线如下:
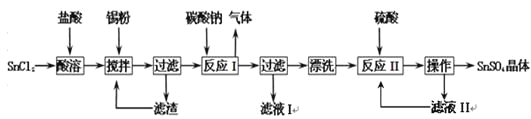
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是 ;
(2)反应I得到的沉淀是SnO,得到该沉淀的离子方程式是 ;
(3)在反应I得到沉淀SnO后,要进行“过滤”、“漂洗”,检验SnO是否洗涤干净的操作是 ;
(4)反应II之后的“操作”依次为 、 、过滤、洗涤、低温干燥;
(5)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3溶液;③用0.2000 mol/L 酸性K2Cr2O7溶液滴定(产物中Cr呈+3价)至终点,消耗K2Cr2O7溶液15.00 mL。写出酸性K2Cr2O7溶液滴定的离子方程式 ,则此锡粉样品中锡的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是
①用尿素和甲醛制脲醛树脂包括加成反应和缩聚反应。
②标准状况下,22.4 L甲醛所含电子数约为16 NA 。
③甲醇通常是一种有毒气体,分子中只含极性键
④苯酚与碳酸钠溶液的反应:![]() [
[
⑤ 的名称为:2,2,4-三甲基-4-戊烯
的名称为:2,2,4-三甲基-4-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
A.①②④⑥ B.②④⑥ C.②⑤ D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华民族有着光辉灿烂的发明史,下列发明创造的主要原理不涉及化学变化的是
A. 黑火药的使用 B. 用铁矿石炼铁
C. 打磨磁石制备指南针 D. 造纸术的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.1100OC时,在恒容密闭容器中,发生可逆反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
并达到平衡,请完成下列各题:
(1)达到平衡时的平衡常数表达式K=_______________。降低温度,K值减小,则正反应为____________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
A.正向移动 B.逆向移动 C.不发生移动
①加入少量Na2SO4,则平衡:__________(填所选字母)
②加入少量灼热的Fe3O4 ,则平衡:_________(填所选字母)
II.将CH4设计成燃料电池,其利用率更高,装置示意如右图

(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①0<V≤44.8L时,电池总反应方程式为________________;
②44.8L<V≤89.6L时,负极电极反应为_________________;
③V=67.2L时,溶液中阴离子浓度大小关系为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号[ | H2C2O4溶液[ | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为____________________________;
(2)探究温度对化学反应速率影响的实验编号是 ,探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
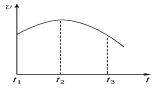
(4)该反应的速率v和时间t的关系如图所示,在t1~t2时段反应速率________(填“加快”或“减慢”或“变化不明显”),主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.道尔顿发现了元素周期律,制订了第一张科学的元素周期表
B.短周期中包含了18种原子
C.元素的性质呈现周期性变化的根本原因是核外电子排布的周期性变化
D.周期表中所有元素,都是从自然界中发现的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com