
【题目】下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.化学反应的限度不可以通过改变条件而改变
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是

A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)

(1)B的官能团的名称是_______________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共振氢谱有3组峰,则C的结构简式 ______________________。
(3)由D生成N的反应类型是_________,B与C反应生成M的反应类型是_________。
(4)写出M与NaOH溶液反应的化学方程式是__________________________________。
(5)物质F的结构是: ,则符合下列条件的F的同分异构体有 ______种。
,则符合下列条件的F的同分异构体有 ______种。
①能发生银镜反应 ②能与NaHCO3溶液反应 ③分子中有苯环,无 结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:2:2:1的为___________(写结构简式)。
结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:2:2:1的为___________(写结构简式)。
(6)已知: ,写出以苯酚、乙醇和ClCH2COOH为原料制备
,写出以苯酚、乙醇和ClCH2COOH为原料制备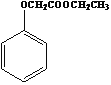 的合成路线流程图(无机试剂任用)。___________
的合成路线流程图(无机试剂任用)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数,下列叙述中正确的是( )
表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,![]() 二氧化硫含有的原子数等于
二氧化硫含有的原子数等于![]()
B.标准状况下,![]() 中所含分子数为
中所含分子数为![]()
C.常温常压下,![]() 水所含电子数为
水所含电子数为![]()
D.常温常压下,![]() 与
与![]() 混合物含有的硫原子数为
混合物含有的硫原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应,也不与氢氧化钠反应),实验步骤如下:
①配制![]() 稀盐酸和
稀盐酸和![]() 溶液各
溶液各![]()
②取一粒药片(![]() )研碎后加入
)研碎后加入![]() 蒸馏水
蒸馏水
③加入![]() 稀盐酸
稀盐酸
④用![]() 溶液中和过量盐酸,用去体积为
溶液中和过量盐酸,用去体积为![]() 。
。
请回答下列问题:
(1)测定过程中发生反应的离子方程式_________。
(2)配制上述![]() 稀盐酸所用玻璃仪器有量筒、烧杯、________。
稀盐酸所用玻璃仪器有量筒、烧杯、________。
(3)如果选用酚酞作指示剂,滴定达到终点的现象为____。
(4)某同学四次测定的![]() 数据如下:
数据如下:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数为_____。
(5)若在实验过程中存在下列操作,会使所测碳酸钙的质量分数偏高的是_________。
a 用没有润洗的碱式滴定管装![]() 溶液进行滴定
溶液进行滴定
b 用没有润洗的酸式滴定管量取![]() 稀盐酸溶解样品
稀盐酸溶解样品
c 用![]() 溶液滴定时,开始读数平视,终点俯视
溶液滴定时,开始读数平视,终点俯视
d 装![]() 溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
查看答案和解析>>
科目:高中化学 来源: 题型:
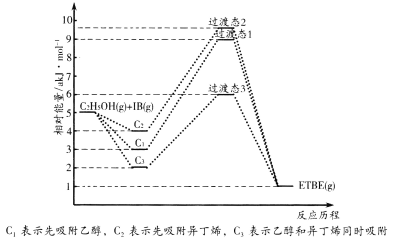
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H。回答下列问题:
ETBE(g) △H。回答下列问题:
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__kJ·mol-1。反应历程的最优途径是__(填C1、C2或C3)。
(2)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH=-270kJ·mol-1
2CO2(g)+S(l) ΔH=-270kJ·mol-1
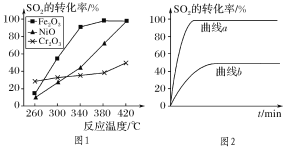
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:__。
②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为__。
(3)已知NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=__;在图标出点中,指出能表示反应达到平衡状态的点是__,理由是__。
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数Kθ=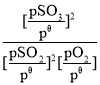 ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。
SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=___(用含ω的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-Fe(Ⅲ)铁原子簇是合成氨工业的新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①H2(g)═2H(g) △H1,②N2(g)+2H(g)![]() 2(NH)(g) △H2,③NH(g)+H(g)
2(NH)(g) △H2,③NH(g)+H(g)![]() (NH2) △H3,④(NH2)(g)+H(g)
(NH2) △H3,④(NH2)(g)+H(g)![]() NH3(g) △H4,总反应为N2(g)+3H2(g)
NH3(g) △H4,总反应为N2(g)+3H2(g)![]() 2NH3(g) △H。下列说法正确的是( )
2NH3(g) △H。下列说法正确的是( )
A.△H═3△H1+△H2+2△H3+2△H4
B.催化剂能够有效降低反应的活化能并改变反应的焓变
C.反应①和总反应均为放热反应
D.增大压强和使用高效催化剂均有利于提高反应②③④的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com