
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H。回答下列问题:
ETBE(g) △H。回答下列问题:
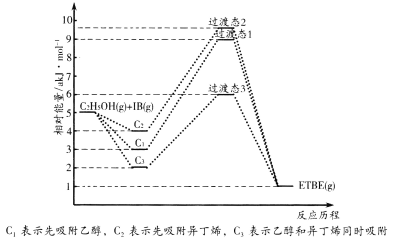
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__kJ·mol-1。反应历程的最优途径是__(填C1、C2或C3)。
(2)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH=-270kJ·mol-1
2CO2(g)+S(l) ΔH=-270kJ·mol-1
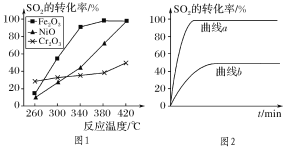
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:__。
②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为__。
(3)已知NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=__;在图标出点中,指出能表示反应达到平衡状态的点是__,理由是__。
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数Kθ=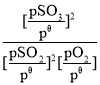 ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。
SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=___(用含ω的最简式表示)。
【答案】-4a C3 Fe2O3作催化剂时,在相对较低的温度可获得较高的SO2转化率,从而节约能源 a k1=2k2·KP BD 达到平衡时,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4) ![]()
【解析】
(1)由图可知,反应物总能量大于生成物总能量,为放热反应,由图给数据可计算△H;活化能的大小可以反映化学反应发生的难易程度,活化能越小,反应越容易进行;
(2)①Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,从而节约大量能源;
②n(CO):n(SO2)=2:1时反应速率界于n(CO):n(SO2)=3:1和n(CO):n(SO2)=1:1之间,反应速率介于二者之间,且二氧化硫的转化率和n(CO):n(SO2)=3:1是相等的;
(3)当反应达到平衡时,正逆反应速率相等,NO2与N2O4的消耗速率的关系为v(NO2)=2v(N2O4),则k1p2(NO2)=2k2p(N2O4);满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2;
(4)设SO2和O2起始物质的量为2mol和1mol,由SO3的平衡产率为ω可知,平衡时SO3的物质的量为2ω,由题意建立三段式计算可得。
(1)由图可知,反应物总能量大于生成物总能量,为放热反应,则该反应的△H=—(5—1)akJ/mol=—4 akJ/mol;活化能的大小可以反映化学反应发生的难易程度,过渡态1和2的活化能都为6akJ/mol,过渡态3的活化能为4akJ/mol,活化能越小,反应越容易进行,过渡态3的活化能最小,反应历程最优,故答案为:-4a;C3;
(2)①根据图示内容,对比260℃时不同催化剂作用下SO2的转化率,可以看出Cr2O3作催化剂时,反应速率最快,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,但是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,从而节约大量能源,故答案为:Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,从而节约大量能源;
②n(CO):n(SO2)=2:1时反应速率界于n(CO):n(SO2)=3:1和n(CO):n(SO2)=1:1之间,反应速率介于二者之间,且二氧化硫的转化率和n(CO):n(SO2)=3:1是相等的,Fe2O3作催化剂时,曲线a符合,故答案为:a;
(3)反应的化学平衡常数Kp=![]() ,当反应达到平衡时,正逆反应速率相等,NO2与N2O4的消耗速率的关系为v(NO2)=2v(N2O4),则k1p2(NO2)=2k2p(N2O4),k1=2k2·KP;满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点,故答案为:2k2·KP;BD;
,当反应达到平衡时,正逆反应速率相等,NO2与N2O4的消耗速率的关系为v(NO2)=2v(N2O4),则k1p2(NO2)=2k2p(N2O4),k1=2k2·KP;满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点,故答案为:2k2·KP;BD;
(4)设SO2和O2起始物质的量为2mol和1mol,由SO3的平衡产率为ω可知,平衡时SO3的物质的量为2ω,由题意建立如下三段式:
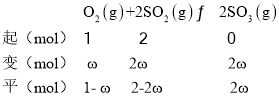
由三段式可得p(SO3)、p(O2)和p(SO![]() ×pθ、
×pθ、![]() ×pθ、
×pθ、![]() ×pθ,则标准平衡常数Kθ=
×pθ,则标准平衡常数Kθ=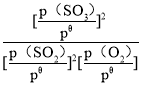 =
=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
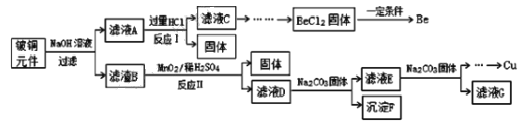
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收铍和铜两种金属的工艺流程如图:
已知:
Ⅰ.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的成分除 NaOH、Na2BeO2外,还有________(填化学式),写出反应I中Na2BeO2,与过量盐酸反应的化学方程式:_________________。
(2)从滤液C 中提纯纯BeCl2,最合理的实验步骤顺序为_________(填字母)
a.加入过量的氨水 b.通入过量 CO2 c.加入过量NaOH溶液 d.加入适量HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的离子方程式:__________。若用浓HNO3溶解金属硫化物,缺点是________(任写一条)
(4)滤液D中c(Cu2+)= 2.2 molL-1、c(Fe3+) = 8.0×10 -3molL-1、c(Mn2+)= 0.01molL-1,逐滴加入 Na2CO3溶液调节pH 可将其转变成氢氧化物依次分离,首先沉淀的是______ (填离子符号)。为使铜离子开始沉淀,常温下应调节溶液的pH____4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.化学反应的限度不可以通过改变条件而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由乙苯生产苯乙烯的反应如下,下列有关说法正确的是 ( )
 +H2
+H2
A.该反应的类型为取代反应
B.苯乙烯分子中所有原子一定在同一平面上
C.乙苯和苯乙烯都能发生氧化反应
D.比乙苯多一个碳原子的同系物R的同分异构体(包含R,不含立体异构)共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸亚铁又称富血铁,可用于治疗缺铁性贫血。以下是合成富马酸亚铁的一种工艺路线:

回答下列问题:
(1)A的化学名称为________;由A生成B的反应类型为______。
(2)C的结构简式为______。
(3)富马酸的结构简式为______。
(4)检验富血铁中是否含有Fe3+需要用的试剂是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
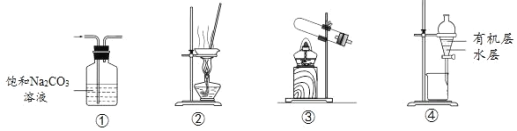
A.用①装置除去CO2中含有的少量SO2
B.用②装置蒸干饱和AlCl3溶液制备AlCl3晶体
C.用③装置加热NH4Cl固体制取NH3
D.用④装置分离乙酸乙酯与水的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中正确的是

A.X应为直流电源的正极
B.电解过程中阴极区pH升高
C.图中的b%<a%
D.SO32-在电极上发生的反应为SO32-+2OH--2e-=SO42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】示意图甲为锌铜原电池装置,乙为电解熔融氯化钠制备金属钠的装置。 下列说法正确的是
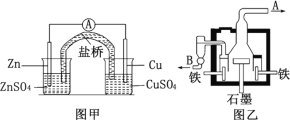
A.甲装置中锌为负极,发生还原反应;铜为正极,发生氧化反应
B.甲装置盐桥可以使反应过程中溶液保持电中性
C.乙装置中铁极的电极反应式为:2Na-2e- = 2Na+
D.乙装置中 B 是氯气出口,A 是钠出口
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com