
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸亚铁又称富血铁,可用于治疗缺铁性贫血。以下是合成富马酸亚铁的一种工艺路线:

回答下列问题:
(1)A的化学名称为________;由A生成B的反应类型为______。
(2)C的结构简式为______。
(3)富马酸的结构简式为______。
(4)检验富血铁中是否含有Fe3+需要用的试剂是_________________。
【答案】环己烷 取代反应 ![]()
![]() KSCN溶液
KSCN溶液
【解析】
环己烷和氯气在光照条件下发生取代生成B(![]() ),B在氢氧化钠醇溶液中发生消去反应生成
),B在氢氧化钠醇溶液中发生消去反应生成![]() ,
,![]() 与溴的四氯化碳溶液发生加成反应生成
与溴的四氯化碳溶液发生加成反应生成![]() ,
,![]() 发生消去反应生成
发生消去反应生成![]() ,
,![]() 与氯气在光照条件下发生取代反应生成
与氯气在光照条件下发生取代反应生成![]() ,
,![]() 反应生成
反应生成![]() ,
,![]() 发生消去反应得到
发生消去反应得到![]() ,
,![]() 酸化得到
酸化得到![]() 。据此解答。
。据此解答。
(1)A的化学名称为环己烷,由A生成B是在氯气光照条件下,其反应类型为取代反应;故答案为:环己烷;取代反应。
(2)B到C发生加成反应,因此C的结构简式为![]() ;故答案为:
;故答案为:![]() 。
。
(3)![]() 酸化得到富马酸,其结构简式为
酸化得到富马酸,其结构简式为![]() ;故答案为:
;故答案为:![]() 。
。
(4)铁离子与KSCN溶液反应变为红色,因此检验富血铁中是否含有Fe3+需要用的试剂是KSCN溶液;故答案为:KSCN溶液。


科目:高中化学 来源: 题型:
【题目】按要求填空
名称 | 结构简式 | ||
(1) | ___ | (6)最简单的有机物 | ___ |
(2) | ___ | (7)对氢气的相对密度为46的某芳香烃 | ___ |
(3) | ___ | (8)甘油 | ___ |
(4) | ___ | (9)最重要的化工石油水平衡量标准 | ___ |
(5)HCHO | ___ | (10)碳原子数在3-6的烷烃中其一氯代物只有一种 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数,下列叙述中正确的是( )
表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,![]() 二氧化硫含有的原子数等于
二氧化硫含有的原子数等于![]()
B.标准状况下,![]() 中所含分子数为
中所含分子数为![]()
C.常温常压下,![]() 水所含电子数为
水所含电子数为![]()
D.常温常压下,![]() 与
与![]() 混合物含有的硫原子数为
混合物含有的硫原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应,也不与氢氧化钠反应),实验步骤如下:
①配制![]() 稀盐酸和
稀盐酸和![]() 溶液各
溶液各![]()
②取一粒药片(![]() )研碎后加入
)研碎后加入![]() 蒸馏水
蒸馏水
③加入![]() 稀盐酸
稀盐酸
④用![]() 溶液中和过量盐酸,用去体积为
溶液中和过量盐酸,用去体积为![]() 。
。
请回答下列问题:
(1)测定过程中发生反应的离子方程式_________。
(2)配制上述![]() 稀盐酸所用玻璃仪器有量筒、烧杯、________。
稀盐酸所用玻璃仪器有量筒、烧杯、________。
(3)如果选用酚酞作指示剂,滴定达到终点的现象为____。
(4)某同学四次测定的![]() 数据如下:
数据如下:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数为_____。
(5)若在实验过程中存在下列操作,会使所测碳酸钙的质量分数偏高的是_________。
a 用没有润洗的碱式滴定管装![]() 溶液进行滴定
溶液进行滴定
b 用没有润洗的酸式滴定管量取![]() 稀盐酸溶解样品
稀盐酸溶解样品
c 用![]() 溶液滴定时,开始读数平视,终点俯视
溶液滴定时,开始读数平视,终点俯视
d 装![]() 溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法正确的是( )
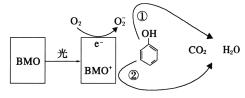
A.该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO表现出较强氧化性
C.光催化降解过程中,光能转化为化学能、电能等
D.①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
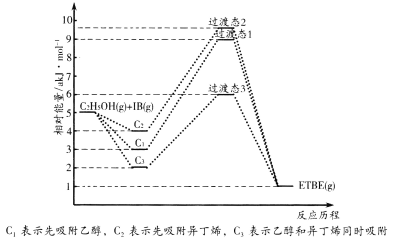
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H。回答下列问题:
ETBE(g) △H。回答下列问题:
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__kJ·mol-1。反应历程的最优途径是__(填C1、C2或C3)。
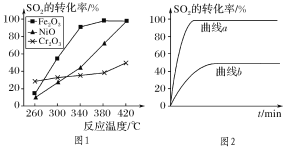
(2)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH=-270kJ·mol-1
2CO2(g)+S(l) ΔH=-270kJ·mol-1
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:__。
②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为__。
(3)已知NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=__;在图标出点中,指出能表示反应达到平衡状态的点是__,理由是__。
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数Kθ=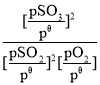 ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。
SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=___(用含ω的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸是传统中药当归、川穹的有效成分之一,工业上合成阿魏酸的原理如下,下列说法不正确的是
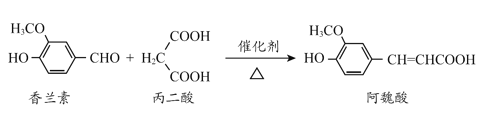 +H2O+CO2
+H2O+CO2
A.阿魏酸分子式为C10H10O4
B.阿魏酸存在顺反异构
C.方程式中三种有机物均可与NaOH、Na2CO3反应
D.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧(DO)的多少是衡量水体水质的重要指标。某化学小组测定某河流中氧的含量,经查阅有关资料了解到溶解氧测定可用“碘量法”,
Ⅰ.用已准确称量的硫代硫酸钠(Na2S2O3)固体配制一定体积的cmol/L标准溶液;
Ⅱ.用水样瓶取河流中水样v1mL并立即依次序注入1.0mLMnCl2溶液和1.0mL碱性KI溶液,塞紧瓶塞(瓶内不准有气泡),反复震荡后静置约1小时;
Ⅲ.向水样瓶中加入1.0mL硫酸溶液,塞紧瓶塞,振荡水样瓶至沉淀全部溶解,此时溶液变为黄色; Ⅳ.将水样瓶内溶液全量倒入锥形瓶中,用硫代硫酸钠标准溶液滴定;
V.待试液呈淡黄色后,加1mL淀粉溶液,继续滴定到终点并记录消耗的硫代硫酸钠溶液体积为v2。
已知:I2 +2Na2S2O3 =2NaI+Na2S4O6
(1)在滴定环节中使用的仪器有滴定管夹、铁架台、烧杯、锥形瓶和________________________。
(2)在步骤Ⅱ中,水样中出现了MnMnO3沉淀,离子方程式为4Mn2++O2+8OH-![]() 2MnMnO3↓+4H2O。
2MnMnO3↓+4H2O。
(3)步骤Ⅲ中发生反应的离子方程式为 _______________________________________________________________。
(4)滴定时,溶液由__________色到______________色,且半分钟内颜色不再变化即达到滴定终点。
(5)河水中的溶解氧为_____________________________mg/L。
(6)当河水中含有较多NO3-时,测定结果会比实际值________(填偏高、偏低或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.某温度时 N2(g)+3H2(g)![]() 2NH3(g),正、逆反应的平衡常数分别为 K1、K2,则 K1·K2=1
2NH3(g),正、逆反应的平衡常数分别为 K1、K2,则 K1·K2=1
B.若一个可逆反应的化学平衡常数很大,则该反应会在较短的时间内完成
C.氢氧燃料电池是一种将热能转化为电能的装置
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com