
【题目】α-Fe(Ⅲ)铁原子簇是合成氨工业的新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①H2(g)═2H(g) △H1,②N2(g)+2H(g)![]() 2(NH)(g) △H2,③NH(g)+H(g)
2(NH)(g) △H2,③NH(g)+H(g)![]() (NH2) △H3,④(NH2)(g)+H(g)
(NH2) △H3,④(NH2)(g)+H(g)![]() NH3(g) △H4,总反应为N2(g)+3H2(g)
NH3(g) △H4,总反应为N2(g)+3H2(g)![]() 2NH3(g) △H。下列说法正确的是( )
2NH3(g) △H。下列说法正确的是( )
A.△H═3△H1+△H2+2△H3+2△H4
B.催化剂能够有效降低反应的活化能并改变反应的焓变
C.反应①和总反应均为放热反应
D.增大压强和使用高效催化剂均有利于提高反应②③④的平衡转化率
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.化学反应的限度不可以通过改变条件而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中正确的是

A.X应为直流电源的正极
B.电解过程中阴极区pH升高
C.图中的b%<a%
D.SO32-在电极上发生的反应为SO32-+2OH--2e-=SO42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=___________。
2CO2(g)+N2(g) △H=___________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=___________;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将___________ (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是___________(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为___________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:焦性没食子酸的碱性溶液可吸收O2。碘化亚铁(FeI2)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性。实验室用如图装置制备FeI2。下列说法错误的是( )
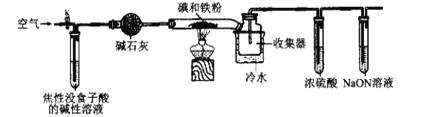
A.空气的主要作用是将产生的FeI2吹入收集器中
B.冷水的作用是将升华的FeI2凝华便于收集,使用粗玻璃管可以防止堵塞
C.浓硫酸的作用是防止水蒸气进入收集器而引起FeI2潮解
D.向FeI2溶液中通入等物质的量的Cl2,反应的离子方程式为:2Fe2++2Cl2=2Fe3++4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法利用 CO2制备甲酸盐可实现 CO2资源化利用, 其装置如图所示:

下列说法错误的是
A.a 极为正极,K+由左向右通过交换膜
B.乙池中的反应为 CO2+HCO3-+2e-= HCOO-+ CO32-
C.电解过程中,Pt 电极产生的气体可以用作燃料电池的负极反应
D.两池的溶液 KHCO3浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】示意图甲为锌铜原电池装置,乙为电解熔融氯化钠制备金属钠的装置。 下列说法正确的是
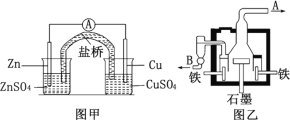
A.甲装置中锌为负极,发生还原反应;铜为正极,发生氧化反应
B.甲装置盐桥可以使反应过程中溶液保持电中性
C.乙装置中铁极的电极反应式为:2Na-2e- = 2Na+
D.乙装置中 B 是氯气出口,A 是钠出口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用麦芽酚 A 制备某药物中间体 X, 其合成路线如下
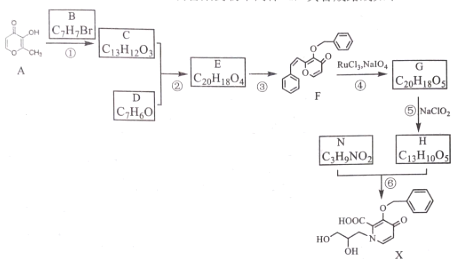
已知:

请回答 :
(l)化合物F的含氧官能团名称为__________,化合物E 的结构简式为____________。
(2)写出反应① 的化学方程式:_________________ 。
(3)下列说法不正确的是__________ ( 填字母序号)。
A.化合物 E 可发生取代、加成、消去、氧化、还原等反应
B.化合物 N 的同分异构体可能是某氨基酸
C.反应③属于消去反应
D.化合物X在一定条件下反应生成的物质中可能含有3个六元环
(4) 写出化合物H同时符合下列条件的同分异构体的结构简式______________。
a.IR 谱检测表明:分子中含有2个独立的苯 环,不含其他的环 ;
b.1H - NMR 谱表明:分子中共有3种化学环境不同的氢原子;
(5)由乙烯和苯为原料合成 D, 利用已知信息,设计合成路线(用流程图表示,无机试剂任选)__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com