
【题目】表中是食用碘盐包装上的部分说明,下列说法正确的是配料( )
配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
碘含量 | 35±15 mg/kg |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A. 高温会导致碘的损失 B. 碘酸钾可氧化氯化钠
C. 可用淀粉检验碘盐中的碘酸钾 D. 该碘盐中碘含量是指碘酸钾的含量
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是102
B. 油酸、苯丙氨酸、葡萄糖分子中均含有两种官能团
C. 由![]() 在浓硫酸加热170℃可发生消去反可制备CH3—CH═CH2
在浓硫酸加热170℃可发生消去反可制备CH3—CH═CH2
D. 用乙酰水扬酸![]() 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A-F共6种有机物,在一定条件下,按图发生转化.

又知烃A的密度(在标准状况下)是氢气密度的13倍,试回答下列问题:
(1)有机物A的结构简式为 __________ 。有机物D中所含官能团名称为 __________ .
(2)有机物的结构简式:E. __________ ,F. __________ .
(3)C→D的反应类型属于 __________.C+E→F的反应类型属于 __________
(4)F的同分异构体中能与NaHCO3反应产生气体的有机物有 __________ 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。

(1)芳香烃:________;
(2) 卤代烃:________;
(3) 醇:________;
(4)醛:________;
(5)羧酸:________;
(6)酯:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ、某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
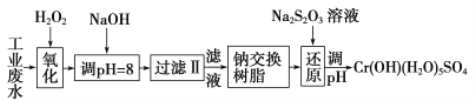
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是_________(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是________(填序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+ E.Fe2+
Ⅱ、酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?____(填“能”或“不能”)。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现:工业革命前的65万年间,地球大气层中的温室气体稳定,CO2含量一直处在180 ppm~289 ppm之间,CH4含量在320 ppb~720 ppb之间,现在大气中的CO2和CH4含量分别高达380 ppm和1700 ppb,导致温室气体含量变化的主要原因是( )
①以煤为能源的机器的广泛使用 ②以石油为能源的机器的广泛使用
③以原子能为能源的核工业的发展 ④以风能、太阳能为能源的新工业的发展
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论正确的是( )
①S2-、Cl、S、F四种微粒半径逐渐减小
②HF、HCl、HBr水溶液酸性逐渐增强
③S2-、Cl-、Br-、I-四种离子的还原性逐渐减小
④Cl2、S、P的氧化性逐渐减弱
⑤H2SO4、HClO4、H2CO3的酸性逐渐减弱
A.②④B.③⑤C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH![]() CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。

(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,这两种仪器是① 。② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com