
【题目】A-F共6种有机物,在一定条件下,按图发生转化.

又知烃A的密度(在标准状况下)是氢气密度的13倍,试回答下列问题:
(1)有机物A的结构简式为 __________ 。有机物D中所含官能团名称为 __________ .
(2)有机物的结构简式:E. __________ ,F. __________ .
(3)C→D的反应类型属于 __________.C+E→F的反应类型属于 __________
(4)F的同分异构体中能与NaHCO3反应产生气体的有机物有 __________ 种.
【答案】 CH≡CH 醛基 CH3COOH CH3COOCH 2CH 3 氧化反应 酯化反应 2
【解析】A的密度(在标准状况下)是氢气的13倍,说明A的分子量是26,所以A是乙炔,乙炔可以和氢气发生加成反应,生成乙烯,所以B是乙烯,乙烯可以和水发生加成反应生成乙醇,即C是乙醇,乙醇催化氧化可以得到乙醛,即D为乙醛,乙醛易被氧化为乙酸,即E是乙酸,乙酸和乙醇之间可以生成乙酸乙酯,即F是乙酸乙酯。
(1)由以上分析可以知道A为CH≡CH,D为乙醛,含有的官能团为醛基;正确答案:CH≡CH;醛基。
(2)由以上分析可以知道E为![]() ,F为
,F为![]() ;正确答案: CH3COOH;CH3COOCH 2CH 3 。
;正确答案: CH3COOH;CH3COOCH 2CH 3 。
(3) 根据以上分析可知,乙醇催化氧化可以得到乙醛,所以C→D的反应类型属于氧化反应;乙酸和乙醇之间可以生成乙酸乙酯,所以![]() →F的反应类型属于酯化反应;正确答案: 氧化反应;酯化反应。
→F的反应类型属于酯化反应;正确答案: 氧化反应;酯化反应。
(4)F为![]() ,对应的同分异构体能与
,对应的同分异构体能与![]() 反应产生气体,说明含有羧基,则对应的同分异构体有
反应产生气体,说明含有羧基,则对应的同分异构体有![]() 、
、![]() ,共2种;正确答案:2。
,共2种;正确答案:2。


科目:高中化学 来源: 题型:
【题目】铜-锌原电池,电解质溶液为稀硫酸,当该原电池工作时
A. 铜电极发生氧化反应 B. 铜电极发生还原反应
C. 电子由铜极经外电路流向锌极 D. 电解质溶液中的H+浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学发现一瓶失去标签的药品,取出少量,观察到该药品为白色固体,加入蒸馏水后,发现白色固体全部溶解,他认为该药品有可能是钠的化合物,需要用焰色反应来进一步验证。上述过程没有用到的科学探究方法是( )
A.假设法B.观察法C.比较法D.实验法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=_________,该反应在_______下能自发进行(填写:高温或低温或任意温度)
2CO2(g)+N2(g) ΔH=_________,该反应在_______下能自发进行(填写:高温或低温或任意温度)
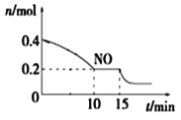
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。

已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:______________________________
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸需经过SO2的制造、SO2的催化氧化和SO3的吸收三个主要阶段,下列说法错误的是( )
A.废渣可做建材B.将矿石粉碎增大反应速率
C.尾气直接排放D.热交换器提高能量利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
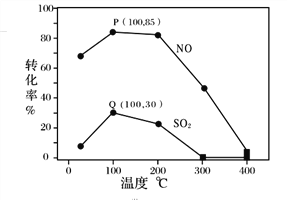
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
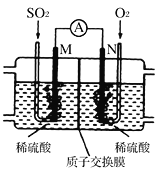
①M极发生的电极反应式为___________________。
②质子交换膜右侧的溶液在反应后pH________(填“增大”、“减小”、“不变”)。
③当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量______(填“增大”或“减小”)_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中是食用碘盐包装上的部分说明,下列说法正确的是配料( )
配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
碘含量 | 35±15 mg/kg |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A. 高温会导致碘的损失 B. 碘酸钾可氧化氯化钠
C. 可用淀粉检验碘盐中的碘酸钾 D. 该碘盐中碘含量是指碘酸钾的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工初始原料,可以由它出发合成很多有机产品,油漆软化剂丁烯酸乙酯的合成途径如下:

完成下列填空:
(1)丁烯酸乙酯的结构简式为______________________________。
(2)C→D的反应类型是____________。
A→B的化学方程式为___________________________________。
(3)写出一种D的同分异构体(与D含有完全相同的官能团)。_________________________________________
(4)请设计实验,检验D是否完全氧化为丁烯酸。____________________________
(5)设计一条由C制备ClCH2CH=CHCH2Cl的合成路线。(合成路线常用的表示方式为:A ![]() B
B ![]() 目标产物)_____________
目标产物)_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com