
【题目】为了确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体为b L(标况)。反应的离子方程式为_______________,样品中铝的物质的量为_____________(用含b的代数式表示)。
(2)若取a g样品,在高温下能恰好完全反应,该反应的化学方程式为________________,样品中氧化铁与铝的质量比为_________________(用含a 、b的代数式表示)。
(3)待(2)中反应产物冷却后,往其中加入足量的盐酸,测得生成的气体体积为c L(标况),则该气体与(1)中所得的气体的体积比c∶b=______________。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑![]() molFe2O3 +2Al
molFe2O3 +2Al![]() 2Fe+Al2O3(a-
2Fe+Al2O3(a-![]() )︰
)︰![]() 2∶3
2∶3
【解析】
(1)铝热剂中的氧化铁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,由方程式可知3n(Al)=2n(H2),n(Al)=![]() ×
×![]() =
= ![]() mol;(2)铝热反应为置换反应,方程式为Fe2O3 +2Al
mol;(2)铝热反应为置换反应,方程式为Fe2O3 +2Al![]() 2Fe+Al2O3,在铝热剂中铝的质量为
2Fe+Al2O3,在铝热剂中铝的质量为![]() ×27g,则氧化铁的质量为(a-
×27g,则氧化铁的质量为(a-![]() ×27)g,故样品中氧化铁与铝的质量比为(a-
×27)g,故样品中氧化铁与铝的质量比为(a-![]() ):
):![]() ;(3)由于样品在高温下恰发完全反应,所以n(Al)=2n(Fe2O3),因此可得ag样品中铝的物质的量与反应后生成铁单质的物质的量,它们在反应中与氢气的关系式分别为2Al~3H2、2Fe~2H2,通过计算可知产生的氢气的物质的量之比为2:3,故c∶b=2:3。
;(3)由于样品在高温下恰发完全反应,所以n(Al)=2n(Fe2O3),因此可得ag样品中铝的物质的量与反应后生成铁单质的物质的量,它们在反应中与氢气的关系式分别为2Al~3H2、2Fe~2H2,通过计算可知产生的氢气的物质的量之比为2:3,故c∶b=2:3。


科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出___________kJ 的热量。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种见图甲、乙:

①这两种结构的区别表现在定性方面(即化学性质方面):
甲能_______(填字母,下同)而乙不能_______。
A.被酸性KMnO4溶液氧化 B.与Br2的CCl4溶液发生加成反应
C.与液Br2在催化剂作用下发生取代反应 D.与H2发生加成反应
②定量方面:1mol C6H6与 H2加成时甲需要______molH2,而乙需要_____molH2。
(2)今发现 C6H6还有另一种如图立体结构: ![]() ,该结构的二氯代物有______种。
,该结构的二氯代物有______种。
(3)已知萘的结构简式为 ,下列关于萘的说法正确的是______ (填编号)。
,下列关于萘的说法正确的是______ (填编号)。
A.萘的分子式为C10H10 B.1mol萘能与6molH2发生加成反应
C.萘分子中所有原子在同一平面上 D.萘的一溴代物只有两种同分异构体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a—淀粉酶的最适温度为60℃,某同学为了探究pH对a—淀粉酶活性的影响,在35℃和45℃两个温度条件下分别设置了7支试管,每支试管中均加入4 mL淀粉溶液(淀粉的初始含量为yo g),然后加入pH缓冲液,设置pH值分别为1.0、3.0、5.0、7.0、9.0、11.0、13.0,再加入2 mL a—淀粉酶溶液,反应3 min盾迅速在每支试管中同时加入足量的NaOH溶液,测定每支试管中的淀粉的剩余量,得到如图所示的曲线。请回答下列问题:
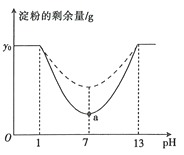
(1)反应3 min后迅速加入足量的NaOH溶液的目的是 。该同学认为反应时间过长或加入的淀粉量少都可能导致实验失败,其依据是酶的催化具有____的特点。
(2)分析图中数据可知,实线部分表示在温度为 条件下测定的结果;使a—淀粉酶完全失活的pH范围为 ;图中a点限制酶促反应速率的外界因素主要是____。
(3)若该同学在某pH条件下测定淀粉的剩余量为y1 g,则用淀粉的消耗速率表示该条件下促反应速率为 g/min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于三种气态烃甲烷、乙烷、乙烯,请回答下列问题:
(1)等质量的三种烃在相同状况下体积最大的是________。
(2)等质量的三种烃完全燃烧时消耗氧气最多的是________。
(3)等质量的三种烃完全燃烧生成二氧化碳最多的是________,生成水最多的是________。
(4)在120 ℃、1.01×105Pa条件下,与足量的氧气混合点燃,完全燃烧前后气体体积没有变化的烃是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的A、B、C、D表示元素周期表中的四个区域:
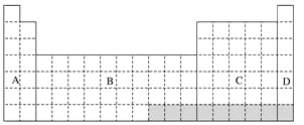
(1)全部是金属元素的区域为____________。
(2)短周期甲元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,甲的原子序数是________。
(3)短周期乙元素的原子核外第三层电子数与第一层电子数相等,则乙元素位于元素周期表的第_______周期第______族。
(4)用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢褪去,其原因是( )
①氯气有漂白性 ②氯气与NaOH溶液反应 ③氯气的水溶液呈酸性 ④次氯酸有漂白性 ⑤氯化钠有漂白性
A.①④B.②③④C.①②③D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
① 将白色粉末加水溶解,得无色溶液。
② 向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向
滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
A的化学式是 B的化学式是
(2)原白色粉末中一定含有 ,可能含有 ,
对可能含有的物质,可通过 (填实验名称)进一步检验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:

(1)甲烷燃料电池负极的电极反应为:____________________________。
(2)b电极上得到的气体是_______,电解氯化钠溶液的总反应方程式为 _____。
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为______L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:负极_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com