
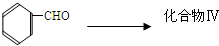
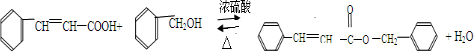
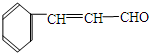 成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):
成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):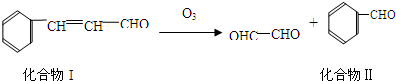

| y |
| 4 |
| z |
| 2 |
| 8 |
| 4 |
| 1 |
| 2 |
 ,
, ;
;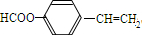 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、v(H2)=0.03mol?L-1?min-1 |
| B、v(N2)=0.02mol?L-1?min-1 |
| C、v(NH3)=0.17mol?L-1?min-1 |
| D、v(NH3)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com