
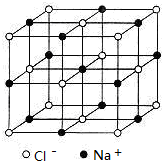
 ,则黑球可以看成是Si原子,“小立方体”中可放置四个Si原子,故SiO2晶胞中有4+1+12×
,则黑球可以看成是Si原子,“小立方体”中可放置四个Si原子,故SiO2晶胞中有4+1+12×| 1 |
| 4 |
| ||
| 2 |
| 2 |
| ||
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、压缩容器体积,增大体系压强 |
| B、加入适当的催化剂 |
| C、保持压强不变,充入惰性气体使容器容积增大 |
| D、保持容器容积不变,充入惰性气体使体系压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
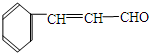 成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):
成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):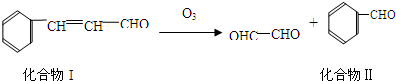

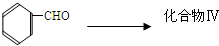
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个原电池(正极材料用碳棒).装置图
利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个原电池(正极材料用碳棒).装置图查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com