
| A. | 氧化性MnO4->IO3- | |
| B. | c=d=5,则该反应转移电子数为30e | |
| C. | 该反应的氧化产物只有IO3- | |
| D. | a、b、c、d之间的关系是:5a=2c+6d;b=2c+d |
分析 反应aMnO4-+bI-+x H+→y Mn2++cI2+dIO3-+zH2O中,Mn元素化合价由+7价降低到+2价,I元素化合价由-1价分别升高到0价、+5价,结合化合价的变化以及电子守恒、质量守恒解答该题.
解答 解:A.同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性MnO4->IO3-,故A正确;
B.至于I元素化合价升高,c=d=5,则由化合价的变化可知转移电子数为5×2+5×(5+1)=40,故B错误;
C.I元素化合价升高,则I2、IO3-为氧化产物,故C错误;
D.Mn元素化合价由+7价降低到+2价,I元素化合价由-1价分别升高到0价、+5价,由电子守恒可知5a=2c+6d,由I元素守恒可知b=2c+d,故D正确.
故选AD.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握元素化合价的变化以及电子守恒、质量守恒的运用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
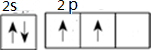
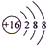 .A+、C2-、D-中离子半径最小的是Na+.
.A+、C2-、D-中离子半径最小的是Na+. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO(aq)中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | FeCl2在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | AlCl3(aq)中投入少量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑ | |
| D. | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.01×105Pa,20℃时48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.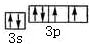 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含四种元素的原子半径由小到大的顺序为:H<O<N<C | |
| B. | 同周期的三种元素的得电子能力由大到小的顺序为:O>N>C | |
| C. | 与足量烧碱溶液共热的离子方程式为:NH4++OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
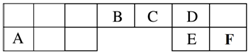 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.
短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 NaOH NaHCO3 | B. | NaHCO3 CaCl2 HCl | ||
| C. | AlCl3 MgCl2 NaOH | D. | Ba(OH)2 CaCl2 H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com