
����Ŀ����12�֣���֪���ᣨHCOOH����������ᣬ��������������ʣ���ʵ�����ﳣ�ü�����Ũ�������������ȡ����һ����̼�����ü�����״���Ӧ��ȡ�����������֤�����ܷ���������Ӧ��װ������ͼ��ʾ���ش��������⣺

��1��ʵ�������ѡ���Լ�����Ʒ��Ũ���ᡢ�״������ᣬ����____________��___________�������ʡ�
��2�����Թ�����Һ���������ܽ�״������ռ��ᣬ����_____________��
��3�������Թ�����Һ��NaOH��Һ�����ռ����IJ����Ԥ�ڵ��٣���ԭ����______
��4�����ɼ�������ķ�Ӧ�Ļ�ѧ����ʽΪ__________��
��5����ʵ������е���b___����ܡ����ܡ���ֱ���������ͨ������Ϊ______��
���𰸡� ����Na2CO3��Һ ���Ƭ ���������ܽ�ȣ������������� ��������ڼ���������ˮ����һ���� HCOOH+CH3OH![]() HCOOCH3+H2O ���� CO��CH3OH�����ж����ʣ��Ի�������Ⱦ
HCOOCH3+H2O ���� CO��CH3OH�����ж����ʣ��Ի�������Ⱦ
������������ʵ�����Ʊ����������ķ�Ӧ���ƿ�֪��1��ʵ�������ѡ�õ��Լ�����Ʒ��Ũ���ᡢ�״������ᣬ���б���Na2CO3��Һ�����Ƭ(���ʯ)����2�����Թ�����Һ���������ܽ�״������ռ��ᣬ���н��ͼ��������ˮ�е��ܽ�ȣ����ڷֲ���������������3�����ڼ��������NaOH��Һ���ڵ�������ˮ����һ�����������ռ����IJ����Ԥ�ڵ�������4����ʵ������е���b����ֱ���������ͨ������ΪCO��CH3OH�����ж������ҶԻ�������Ⱦ����5�����ɼ�������Ļ�ѧ��Ӧ����ʽΪHCOOH+CH3OH![]() HCOOCH3+H2O��
HCOOCH3+H2O��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ�飺
��ʵ��һ�����Ʋ��궨������Һ��Ũ�ȡ�ȡ����������250 mL 0.2 mol��L��1�Ĵ�����Һ��Ȼ����0.2 mol��L��1�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ����ϡ�͵Ĵ�����Һ��Ũ�Ƚ��б궨����ش��������⣺
��1������250 mL 0.2 mol��L��1������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�����������__________��
��2��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.200 0 mol��L��1��NaOH��Һ��20.00 mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ �����(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
�����ζ�ʱѡ��________(A.ʯ�B����̪��C������ָʾ�� D.����)Ϊָʾ��������ĸ��
���ô�����Һ��ȷŨ��Ϊ________(����С�������λ)��
��ʵ�����̽��Ũ�ȶԴ������̶ȵ�Ӱ�졣��pH�Ʋⶨ25 ��ʱ��ͬŨ�ȵĴ�����Һ��pH��������£�
����Ũ�� (mol��L��1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
��3�����ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵�������_________________��
��4���ӱ��е����ݣ������Եó���һ���ۣ����Ŵ���Ũ�ȵļ�С������ĵ���̶�______(��������������С������������)��
��ʵ������̽���¶ȶԴ������̶ȵ�Ӱ�졣
��5��Ҫ��ɸ�̽������Ҫ��pH��(��pH��ֽ)�ⶨ ___________________________��
����������Ӧ�á�
��6��ͨ��ʵ��ⶨ�����´����Ka��1��10��5����0.1 mol��L��1��������Һ��pH��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����һ����Ҫ�Ļ���ԭ�ϡ�ijͬѧ��Ƶ����Ȼ����Ʊ�װ������ͼ��

���������ϡ�
��BCl3���۵�Ϊ�D107.3 �棬�е�Ϊ12.5 ��
��2B��6HCl![]() 2 BCl3��3H2
2 BCl3��3H2
��ش��������⣺
��1��Aװ�ÿ��ø�����ع�����Ũ���ᷴӦ����������Ӧ�Ļ�ѧ����ʽΪ________��
��2��Ϊ��������Ȼ�����Ʊ���װ�ô����ҵĽӿ�����˳��Ϊ��_______________
a��(___,___)��(___,___) ��(___,___)��(___,___)��j��
��3��װ��E�е��Լ�Ϊ_______�������ȥEװ�ã����ܵĺ���� _____________��
��4��Dװ���з�����Ӧǰ��ͨ��һ��ʱ�����������Ŀ����__________����װ���з�����Ӧ�Ļ�ѧ����ʽΪ _________________________��
��5�����Ȼ�����ˮ�ܾ��ҷ�Ӧ���������ᣬд���÷�Ӧ�Ļ�ѧ����ʽ ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺ 
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������� ��
��2���ձ�����������ĭ���ϵ������� ��
��3��������ϡ��ǿ����Һ��ǿ����Һ��Ӧ����1molˮʱ�ų�57.3kJ��������д����ʾϡ�����ϡ����������Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ��
��4�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ���ƫ����ƫС������Ӱ�족����
��5��ʵ���и���60mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ�����ȡ����������к��������ȡ�����ȡ������������ɣ� ��
��6������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�����ƫ��ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ij�о���ѧϰС���ij��ɫˮ���ɷֵļ����̣���֪��ˮ����ֻ���ܺ���K+ ��Mg2+��Fe3+��Cu2+��Al3+��Ag+��Ca2+��CO32-��SO42-��Cl-�е����������ӣ���С��ͬѧȡ��100mlˮ������ʵ�飺��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol��L-1���ᣬʵ������г��������������Լ����Ĺ�ϵ�仯����ͼ��ʾ��

��1���۲�֪��ˮ����һ�������е��������� ________
��2��ˮ����һ�����е���������________ ����Ӧ�����ʵ�����Ϊ________
��3���Ը���ʵ�����Ʋ�K+�Ƿ����_______�������������������������ڣ������ʵ���Ũ�ȵķ�Χ��_________ mol��L-1���������ڣ��ػش�
��4����Ƽ�ʵ����֤ԭˮ���п��ܴ��ڵ����� _____________________________________________________��д��ʵ�鲽�衢����ͽ��ۣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о��ԻС����ʵ���������ݲ�ͬ��ʼŨ�ȵİ��������(NH2COONH4)��Һ�ڲ�ͬ�¶��½���ˮ��ʵ�飺NH2COONH4��2H2O![]() NH4HCO3��NH3��H2O�������c(NH2COO-)�뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ����ͼ�ж�����˵����ȷ���ǣ� ��
NH4HCO3��NH3��H2O�������c(NH2COO-)�뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ����ͼ�ж�����˵����ȷ���ǣ� ��
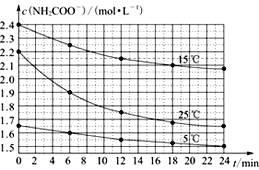
A. 0��12 min����ʼŨ��Խ���ʵ�飬ˮ�ⷴӦ����Խ��
B. c(NH2COO-)���淴Ӧʱ��IJ����ӳ���һֱ��С��0
C. 15 ��ʱ����30 minʱ��c(NH2COO-)Ϊ2.0 mol��L-1
D. 25 ��ʱ0��6 min��v(NH2COO-)Ϊ0. 05 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������(����)
A. �Ҵ������ᶼ�dz��õ�ζƷ����Ҫ�ɷ�
B. �Ҵ�������ķе���۵㶼��C2H6��C2H4�ķе���۵��
C. �Ҵ��ܷ���������Ӧ��������ܷ���������Ӧ
D. �Ҵ�������֮���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ֧50mL��ʽ�ζ�����ʢ���ᣬҺ��ǡ����10 mL�̶ȴ����ѹ���Һ��ȫ���ų���ʢ����Ͳ�ڣ�����Һ������ǣ� ��
A.10mLB.40mLC.����10mLD.����40 mL
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com