
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
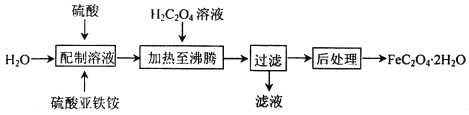
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,除需加硫酸外还需要加少量铁屑的目的是________。
(2)加热至沸腾生成沉淀时反应的化学方程式为________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有________(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为________。
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
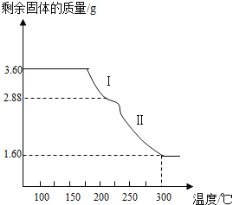
①过程Ⅰ发生反应的化学方程式为________________________。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式___________(写出计算过程)
【答案】防止Fe2+被氧化 (NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4+(NH4)2SO4 还原 0.6mol FeC2O42H2O![]() FeC2O4+2H2O↑ Fe2O3
FeC2O4+2H2O↑ Fe2O3
【解析】
在稀硫酸溶液中配置硫酸亚铁铵,加入草酸沉淀沉淀亚铁离子生成草酸亚铁,静置倾去上层溶液后处理得到草酸晶体,结合题干中的问题、相关物质的性质和氧化还原反应中电子得失守恒分析解答。
(1)配制(NH4)2Fe(SO4)2溶液时,溶液中亚铁离子水解显酸性,需加少量硫酸的目的是抑制其水解,又因为亚铁离子易被氧化,所以还需要加少量铁屑的目的是防止Fe2+被氧化;
(2)沉淀时发生反应为硫酸亚铁铵溶液中加入草酸反应生成草酸亚铁沉淀、硫酸和硫酸铵,反应的化学方程式依据原子守恒配平写出为(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4+(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,同时有气体生成,说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1mol FeC2O42H2O,则参加反应的KMnO4为0.6mol;
(4)①通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为FeC2O42H2O![]() FeC2O4+2H2O↑;
FeC2O4+2H2O↑;
②草酸亚铁晶体中的铁元素质量为:3.6g×56/180=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为:1.60g-1.12g=0.48g,铁元素和氧元素的质量比为:1.12g:0.48g=7:3,设铁的氧化物的化学式为FexOy,则有:56x:16y=7:3,解得x:y=2:3,铁的氧化物的化学式为Fe2O3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
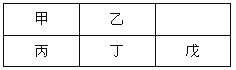
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系前30min各物质的物质的量的浓度变化如图所示。下列说法正确的是
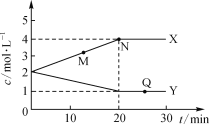
A.该反应的化学方程式为X![]() Y
Y
B.M点的正反应速率小于逆反应速率
C.Q点正、逆反应速率相等,反应停止。
D.前20min反应速率v(X)=0.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
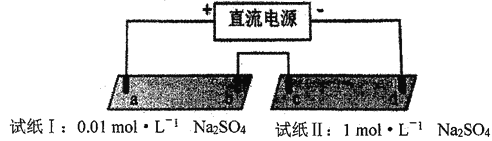
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低B.平衡常数变大C.副反应增多D.反应活化能增大
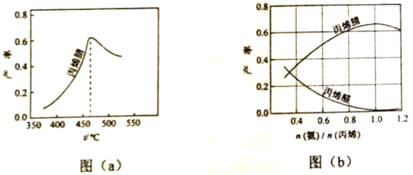
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为1理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。

已知:R1—CH===CH—R2![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
(1)③的反应条件是_________________________________________________。
(2)A的名称是_______________________________________________。
(3)有机物B和I的关系为________(填字母)。
A.同系物 B.同分异构体
C.都属于醇类 D.都属于烃
(4)①~⑩中属于取代反应的________________________________________。
(5)写出反应⑩的化学方程式____________________________________。
(6)写出两种D的属于酯类的链状同分异构体的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为![]() ,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
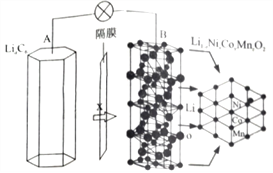
A. 允许离子X通过的隔膜属于阴离子交换膜
B. 充电时,A 为阴极,Li+被氧化
C. 可从无法充电的废旧电池的石墨电极中回收金属锂
D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期前10号元素组成的物质T和X,存在如图所示的转化关系。X不确定,易分解。下列有关说法正确的是
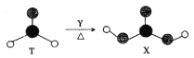
A.为使该转化成功进行,Y可以是酸性KMnO4溶液
B.等物质的量的T、X分子中含有π键的数目均为NA
C.T、X分子中的![]() 原子分别采用sp2杂化和sp3杂化
原子分别采用sp2杂化和sp3杂化
D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com