
【题目】某反应体系前30min各物质的物质的量的浓度变化如图所示。下列说法正确的是
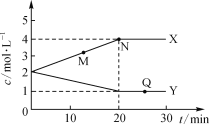
A.该反应的化学方程式为X![]() Y
Y
B.M点的正反应速率小于逆反应速率
C.Q点正、逆反应速率相等,反应停止。
D.前20min反应速率v(X)=0.1mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】将纯锌和纯铜按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
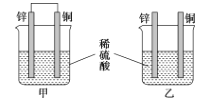
A.产生气泡的速率甲比乙快
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.两烧杯中铜片表面均有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_______,提供孤电子对的成键原子是________。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。
(l)我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是 ____。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:____。
(2)自然界的硫循环过程如下图所示。
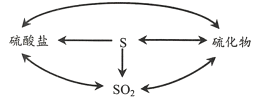
①上图所涉及的含硫物质中,能使品红溶液褪色的是____。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做____(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3,该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某另类元素周期表的一部分,下列说法正确的是( )

A. 简单阴离子的半径大小:X>Y>Z
B. 单质的氧化性:X>Y>Z
C. Y的氢化物只有一种
D. X的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
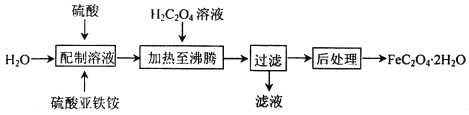
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,除需加硫酸外还需要加少量铁屑的目的是________。
(2)加热至沸腾生成沉淀时反应的化学方程式为________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有________(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为________。
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
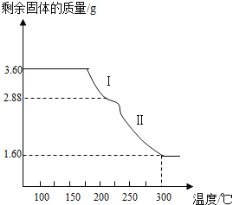
①过程Ⅰ发生反应的化学方程式为________________________。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式___________(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一座巨大的化学资源宝库,从中可以提取多种化学物质。从淡化海水中提取溴是海水综合利用的重要途径,其流程如图:

完成下列填空
(1)写出一种工业上海水淡化的方法_____。
(2)过程Ⅱ中物质X可以选SO2吸收溴,写出该反应的化学方程式_____。
(3)过程I、Ⅱ要达到的目的是_____。
(4)写出过程Ⅲ反应的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com