
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入过量氢氧化钡溶液:SO42-+Ba2+ ![]() BaSO4↓
BaSO4↓
B. 向CH3COOH中加入足量的氢氧化钠溶液: CH3COOH+OH- ![]() CH3COO-+H2O
CH3COO-+H2O
C. 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2 +2H+![]() Fe2++2H2O
Fe2++2H2O
D. 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++ OH- ![]() NH3·H2O
NH3·H2O
【答案】B
【解析】
A.向明矾溶液中加入过量的氢氧化钡溶液,反应的离子方程式为: Al3++SO42-+Ba2++4OH- ![]() BaSO4↓+ AlO2-+2H2O,故A错误; B.向CH3COOH中加入足量的氢氧化钠溶液,反应的离子方程式为: CH3COOH+OH-
BaSO4↓+ AlO2-+2H2O,故A错误; B.向CH3COOH中加入足量的氢氧化钠溶液,反应的离子方程式为: CH3COOH+OH- ![]() CH3COO-+H2O,故B正确;C.向氢氧化亚铁中加入足量的稀硝酸,反应的离子方程式为: 3Fe(OH)2 +NO3-+10H+
CH3COO-+H2O,故B正确;C.向氢氧化亚铁中加入足量的稀硝酸,反应的离子方程式为: 3Fe(OH)2 +NO3-+10H+![]() 3Fe3++8H2O+NO
3Fe3++8H2O+NO![]() ,故C错误;D.向碳酸氢铵溶液中加入足量的氢氧化钠溶液,反应的离子方程式: NH4++HCO3-+ 2OH-
,故C错误;D.向碳酸氢铵溶液中加入足量的氢氧化钠溶液,反应的离子方程式: NH4++HCO3-+ 2OH- ![]() CO32+-NH3·H2O+H2O,所以D错误的;答案:B。
CO32+-NH3·H2O+H2O,所以D错误的;答案:B。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为_______________________(填离子符号)。
(2)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,该反应的化学方程式为___________________。
(3)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为__________。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为________________。
(4)现取100 mL1 mol/L的E的氯化物溶液,向其中加入1 mol/L NaOH溶液产生了3.9g沉淀,则加入的NaOH溶液体积可能为_________________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用以下装置探究氯气和氨气之间的反应情况。其中A、F分别为氨气和氯气的制取发生装置,C为纯净干燥的氯气与干燥的氨气发生反应的装置。请回答下列问题:

(1)实验室通常用来制取氨气的化学方程式为 ________________________;
(2)实验室收集制备得到的氨气的常用方法是______________________。
(3)请为B处虚线框内选择可能合适的装置以及相应的试剂名称______填序号。
A.球形干燥管装碱石灰 B.洗气瓶装浓硫酸
C.球形干燥管装氧化钙 D.球形干燥管装氢氧化钠
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一请写出反应的化学方程式: __________________若有1molNH3被氧化,则转移的电子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.葡萄糖和蔗糖互称同系物
B.等物质的量的甲烷和氯气反应可制取纯净的一氯甲烷
C.用NaOH溶液除去乙酸乙酯中混有的乙酸和乙醇
D.甲苯能发生氧化反应、加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计实验检验生铁与浓硫酸反应的产物。回答下列问题:
Ⅰ.设计如下方案,检验气体产物中的CO2、SO2和H2O。
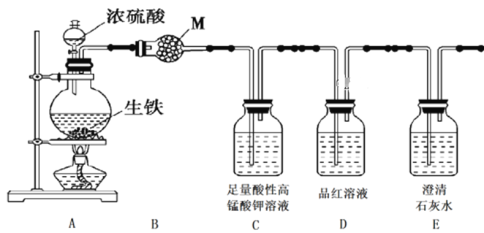
(1)干燥管B中M的化学式是______________________;
(2)C装置的作用是_________________________________________________;
(3)能证明有二氧化碳生成的实验现象是_______________________________;
(4)待生铁与浓硫酸反应完毕后,检验烧瓶中的溶液含有Fe3+的试剂是:________________。
Ⅱ.该课题组同学认为生铁与浓硫酸反应可能有氢气生成。为了验证这一猜想,选择下列仪器和药品并结合上述装置,重新设计实验。
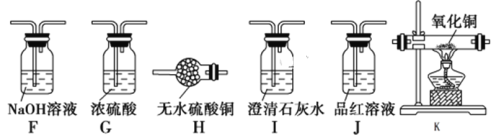
(5)根据实验设计的简约性原则,气流从左至右,仪器排序为______________。
(6)能证明有氢气生成的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做焰色反应实验时所用的铂丝,每次用毕后都要
A.用水多洗几次
B.先用稀盐酸洗,再用水洗
C.用稀盐酸洗,再在火焰上灼烧到没有什么颜色为止
D.放在火焰上灼烧,直到铂丝发红为止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”“偏
小”“无影响” )。
(4)倒入NaOH溶液的正确操作是_________________________,使盐酸与NaOH溶液混合均匀的正确操作是___________________________。平行地做一次这样的实验需要测定_____次温度。
(5)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.9 ℃,则最终代入计算式的温度差的平均值为________ ℃。已知水的比热容为C为4.18J/(g·℃),稀盐酸和稀氢氧化钠溶液的密度别为ρ1、ρ2用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热ΔH=____________________ kJ/mol(请写出简化的代数式,否则不给分)。
(6)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______________。(填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com