
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为_______________________(填离子符号)。
(2)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,该反应的化学方程式为___________________。
(3)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为__________。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为________________。
(4)现取100 mL1 mol/L的E的氯化物溶液,向其中加入1 mol/L NaOH溶液产生了3.9g沉淀,则加入的NaOH溶液体积可能为_________________________mL。
【答案】S2-> O2-> Al3+ 3SCl2+4H2O=2S+H2SO4+6HCl ![]() 2:1 150或350
2:1 150或350
【解析】
A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,则A、B、C、D分别为H、C、N、O等4种元素。E单质可用于野外焊接钢轨的原料,则E为铝,F与D同主族,则F为S,G为氯元素。
根据以上分析,A、B、C、D、E、F、G分别为H、C、N、O、Al、S、Cl,
(1)D、E的离子只有2个电子层(核电荷数小的半径大)、F的离子有3个电子层,所以半径由大到小的顺序为S2-> O2-> Al3+。
因此,本题正确答案是:S2-> O2-> Al3+;
(2)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,则该化合物为二氯化硫,该化合物与水反应生成硫、硫酸和氯化氢,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl。
因此,本题正确答案是:3SCl2+4H2O=2S+H2SO4+6HCl;
(3)C能分别与A和D按原子个数比1:2形成化合物N2H4和NO2,乙的结构式为![]() 。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的化学方程式为2N2H4+2NO2=3N2+4H2O,所以该反应的氧化产物与还原产物的物质的量之比为2:1。
。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的化学方程式为2N2H4+2NO2=3N2+4H2O,所以该反应的氧化产物与还原产物的物质的量之比为2:1。
因此,本题正确答案是:![]() ;2:1;
;2:1;
(4)100 mL1 mol/L的氯化铝溶液中含氯化铝0.1mol,向其中加入1 mol/L NaOH溶液产生了0.05mol氢氧化铝,则可能有两种情况,一是加入0.15molNaOH,二是加入0.35molNaOH,则加入的NaOH溶液体积可能为150或350mL。
因此,本题正确答案是:150或350。


科目:高中化学 来源: 题型:
【题目】下列反应中,属于消去反应的是 ( )
A.溴乙烷和氢氧化钠溶液混合加热
B.一氯甲烷与苛性钠的乙醇溶液混合共热
C.氯苯与氢氧化钠溶液混合加热
D.1—碘丁烷与氢氧化钾的乙醇溶液混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:

下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
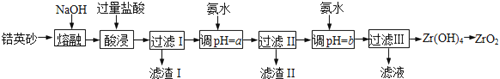
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,在各个方面都起着重要的作用。
(1)材料是经济和生态文明建设的重要物质基础。
合成塑料在生活中广泛应用,乙烯形成聚乙烯的方程式:_____________________。该反应的反应类型:_________________.橡胶是制造轮胎的重要原料,橡胶属于____________________填字母。
A金属材料 B无机非金属材料 C有机高分子材料
铝热反应在工业生产中的重要用途之一是焊接钢轨,其反应的化学方程式为:______________________________________;钢铁制品在潮湿的空气中能发生腐蚀,发生该腐蚀时的负极反应式为__________________________________。
(2)“三高症”是指高血糖糖尿病、高血脂和高血压症,是现代社会中的“富贵病”。
①血糖是指血液中的葡萄糖。葡萄糖的结构简式是__________________________。在加热条件下,加入氢氧化钠溶液,调节溶液为碱性,此时葡萄糖与新制的氢氧化铜发生反应,观察到的现象是________________此方法曾经用于检测糖尿病。
②血脂是血液中所含脂类物质的总称。油脂对人体的作用之一是________,但过量摄入,可能引起肥胖、高血脂、高血压。油脂在碱性条件下水解反应称为_____________.
③高血压可由肥胖、糖尿病、摄入过多钠盐等引起,而摄入过量的蛋白质也会造成脂肪堆积。蛋白质水解的最终产物是________,蛋白质的组成元素除C、H、O外,还含有_______(填一种)。
(3)石油在生活中的应用广泛。石油是由多种碳氢化合物组成的混合物,从原油中分离出汽油、煤油、柴油等轻质油的方法是____________________(填操作名称).分离出的汽油_______(填“是”或者“否”)可作萃取剂。汽油是C5~C11的混合烃,其中含有5个碳原子的烷烃存在________种同分异构体,其中一种同分异构体的一氯代物只有一种,则该同分异构体与氯气发生取代反应生成一氯代物的化学方程式为:___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在生产生活中应用广泛。回答下列问题:
(1)铁铵矾是一种化学物质,分子式是 NH4Fe(SO4)2·12H2O,其溶于水后,溶液中的离子浓度大小关系为__________________。
(2)已知某溶液中含有 CO32-、SO42-等离子,取一定量的该溶液,向其中滴加BaCl2溶液,当 CO32-开始沉 淀时,溶液中c(CO32-)/c(SO42-)为_______________。(已知 Ksp(BaSO4 )=1.0×10-10 ,Ksp(BaCO3)=2.5×10-9 )
(3)已知:S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-50.2kJ·mol-1 。断裂 1molCl-Cl键、1molS-S键分别需要吸收 243kJ、268kJ 的能量,则断裂 1mol S-Cl键需要吸收的能量为____kJ。
(4)用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3 溶液进行电解,可以制备H2SO4,其原理如下图所示(电极材料为石墨)。
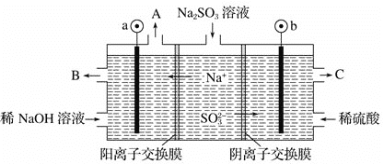
阳极的电极反应式为______________________;其中可循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期主族元素 W、M、X、Y、Z 原子序数依次增大,请结合表中信息回答下列问题:
元素 | W | M | X | Y | Z |
结构或性质 | 最高价含氧 酸与其气态 氢化物能发 生化合反应 | 氢化物的水 溶液能刻蚀 玻璃 | 焰色反应火 焰呈黄色 | 同周期主族元 素形成的简单 离子中,其离子 半径最小 | 最高正价与 最低负价代 数和为 6 |
(1)M元素在周期表中的位置为_____。
(2)M、X、Z元素所对应简单离子半径由大到小的顺序为_____________________(用离子符号表示)。
(3)W最高价含氧酸与其气态氢化物发生化合反应生成的物质中含有的化学键类型为___________________________________。
(4)下列可作为比较M和Z的非金属性强弱的依据是_________(填序号)。
A.单质与H2反应的难易程度
B.氢化物的稳定性
C.最高价氧化物的水化物酸性强弱
D.将M的单质通入Z的钠盐溶液观察是否有Z逸出
(5)W能形成多种氢化物,其中一种氢化物可作为火箭燃料,该物质中W与氢元素的质量比为7:1,写出该氢化物的电子式______。该氢化物和 O2 在碱性条件下可形成燃料电池,产生两种无毒物质,写出其负极的电极反应式___________.
(6)Y元素和W元素形成的化合物YW一种新型无机材料,可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,写出有关的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入过量氢氧化钡溶液:SO42-+Ba2+ ![]() BaSO4↓
BaSO4↓
B. 向CH3COOH中加入足量的氢氧化钠溶液: CH3COOH+OH- ![]() CH3COO-+H2O
CH3COO-+H2O
C. 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2 +2H+![]() Fe2++2H2O
Fe2++2H2O
D. 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++ OH- ![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
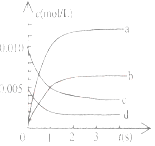
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com