
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
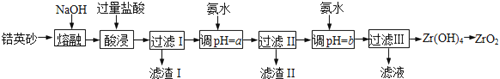
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
【答案】(1)ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;H2SiO3(或H4SiO4);
Na2SiO3+Na2ZrO3+2H2O;H2SiO3(或H4SiO4);
(2)5.2~6.2;ZrO2++2NH3·H2O+H2O= Zr(OH)4↓+2NH4+;
(3)2NH4++CaCO3![]() Ca2++2NH3↑+CO2↑+H2O;
Ca2++2NH3↑+CO2↑+H2O;
(4)取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。
【解析】试题分析:锆英砂(主要成分为ZrSiO4,也可表示为ZrO2SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,ZrSiO4转化为Na2SiO3和Na2ZrO3,加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,滤液中含有ZrO2+、Fe3+、Al3+,加氨水调节pH为5.2~6.2,使Fe3+、Al3+转化为氢氧化物沉淀,过滤,滤液中主要含有ZrO2+,再加氨水调节pH使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,其反应的方程式为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣为H2SiO3;故答案为:ZrSiO4+4NaOH
Na2SiO3+Na2ZrO3+2H2O;加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣为H2SiO3;故答案为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;H2SiO3;
Na2SiO3+Na2ZrO3+2H2O;H2SiO3;
(2)需用氨水调pH=a,使Fe3+、Al3+转化为氢氧化物沉淀,而ZrO2+不能沉淀,根据表中数据可知:pH在5.2~6.2时Fe3+、Al3+完全沉淀,而ZrO2+不沉淀;加氨水至pH=b时,ZrO2+与NH3H2O反应生成Zr(OH)4沉淀,其反应的离子方程式为:ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+;故答案为:5.2~6.2;ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+;
(3)过滤Ⅲ所得滤液中主要含有铵根离子,溶液显酸性,加入CaCO3粉末并加热得到氨气和二氧化碳,其反应的离子方程式为:2NH4++CaCO3![]() Ca2++2NH3↑+CO2↑+H2O;故答案为:2NH4++CaCO3
Ca2++2NH3↑+CO2↑+H2O;故答案为:2NH4++CaCO3![]() Ca2++2NH3↑+CO2↑+H2O;
Ca2++2NH3↑+CO2↑+H2O;
(4)沉淀上附着的杂质为氯离子,用稀硝酸和硝酸银来检验洗液中是否含有氯离子即可,其操作为:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净;故答案为:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g;再通过足量石灰水,石灰水增重17.6g。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
I.现以A为主要原料合成某种具有水果香味的有机物,其合成路线如图所示。

(1)A分子中官能团的名称是______,E的结构简式为________。
(2)写出以下反应的化学方程式,并标明反应类型。反应③的化学方程式是__________; G是生活中常见的高分子材料,合成G的化学方程式是________________________;
Ⅱ.某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
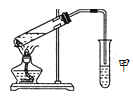
(1)实验开始时,试管甲中的导管不伸入液面下的原因是_______________;当观察到试管甲中________ 现象时认为反应基本完成。
(2)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
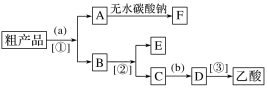
试剂b是____________;分离方法①是__________;分离方法③是________。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律.
Ⅰ.甲同学设计了如下图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。
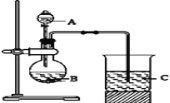
(1)甲同学在连接好仪器后,加入药品之前要检查装置气密性。首先关闭_____,将导管伸入烧杯液面以下,再_____,如果C中______,则说明________
(2)要证明氮、碳、硅非金属性强弱,在A中加________溶液,B中加____溶液,C中加________溶液,将观察到C中__________的现象.但老师认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_______。
(3)为避免上述问题,应在B、C之间增加一个盛有足量____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的离子方程式是__________ .
Ⅱ.丙同学设计了如下图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润淀粉KI试纸、湿润红纸.
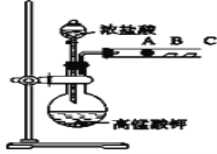
(1)请写出浓盐酸与高锰酸钾反应的离子方程式_________________
(2)A中棉花颜色变_______,则说明非金属性Cl>Br;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是_________
(3)丙同学利用此实验证明卤素单质氧化性:Cl2>Br2>I2,你认为合理吗____,(填“合理”或“不合理”)理由是___________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜:2Cu2O+Cu2S====6Cu+SO2↑。对于该反应,下列说法中正确的是( )
A. 该反应中的氧化剂只有Cu2O B. Cu2S在反应中既是氧化剂又是还原剂
C. Cu既是氧化产物又是还原产物 D. 氧化产物和还原产物的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的叙述错误的是
A.SiO2很稳定,与所有的酸都不反应B.水晶、玛瑙的主要成分都是SiO2
C.陶瓷、玻璃、水泥都是硅酸盐产品D.水玻璃是一种常用的矿物胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为_______________________(填离子符号)。
(2)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,该反应的化学方程式为___________________。
(3)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为__________。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为________________。
(4)现取100 mL1 mol/L的E的氯化物溶液,向其中加入1 mol/L NaOH溶液产生了3.9g沉淀,则加入的NaOH溶液体积可能为_________________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用以下装置探究氯气和氨气之间的反应情况。其中A、F分别为氨气和氯气的制取发生装置,C为纯净干燥的氯气与干燥的氨气发生反应的装置。请回答下列问题:

(1)实验室通常用来制取氨气的化学方程式为 ________________________;
(2)实验室收集制备得到的氨气的常用方法是______________________。
(3)请为B处虚线框内选择可能合适的装置以及相应的试剂名称______填序号。
A.球形干燥管装碱石灰 B.洗气瓶装浓硫酸
C.球形干燥管装氧化钙 D.球形干燥管装氢氧化钠
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一请写出反应的化学方程式: __________________若有1molNH3被氧化,则转移的电子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”“偏
小”“无影响” )。
(4)倒入NaOH溶液的正确操作是_________________________,使盐酸与NaOH溶液混合均匀的正确操作是___________________________。平行地做一次这样的实验需要测定_____次温度。
(5)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.9 ℃,则最终代入计算式的温度差的平均值为________ ℃。已知水的比热容为C为4.18J/(g·℃),稀盐酸和稀氢氧化钠溶液的密度别为ρ1、ρ2用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热ΔH=____________________ kJ/mol(请写出简化的代数式,否则不给分)。
(6)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______________。(填“偏大”“偏小”“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com