
【题目】下列物质的变化过程中,化学键没有被破坏的是( )
A.冰融化为液态水
B.氯化钠受热熔化
C.氢氧化钠溶于水中
D.氯化氢溶于水得到盐酸
科目:高中化学 来源: 题型:
【题目】铝、氧化铝、氢氧化铝等在工业上用途广泛。
(1)用原子结构知识解释Al的金属性比Na弱:Al与Na在元素周期表中位于同一周期,_________________,Al的金属性比Na弱。
(2)结合化学用语,用化学平衡知识解释,氢氧化铝既溶于强酸溶液,又溶于强碱溶液:_______________________。
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式____________。
工业上以铝土矿(主要成分是氧化铝,含氧化铁、氧化镁、二氧化硅、氧化铜等杂质)为原料提取铝、氧化铝、氢氧化铝的无机化工流程如图:
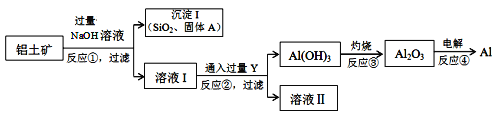
[已知:该条件下NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑]
(4)固体A为________________________________。
(5)写出反应②的离子方程式为___________________________。
(6)反应④所得的铝材中,往往含有少量的铁和硅等杂质,可用电解精炼法进一步提纯,该电解池中阳极的电极反应式为__________________,下列可作阴极材料的是 ______
A.铝材 B.石墨 C.纯铝 D.铅板
(7)铝土矿中Al2O3的含量为40.8%,要使1t铝土矿中的Al2O3全部溶解理论上至少需要NaOH的质量为________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4—、C2O42—的浓度分数δ随溶液pH变化的关系如图,以下说法正确的是( )
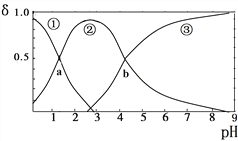
A. HC2O4—的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为NaHCO3 + BaCl2 BaCO3↓+ NaCl+ CO2↑+H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反
应进行的方向和限度的说法中正确的是( )
A. mA(g)+nB(g)![]() pC(g),平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n<p
pC(g),平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n<p
B. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
C. 对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
D. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
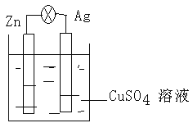
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为____极,电极上发生的是____反应(“氧化”或“还原”)。电极反应式为________,银为______极,电极上发生的是_____反应(“氧化”或“还原”),电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,而且不需要加热,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方式:___________________ 。
(2)E装置的作用是_______________。如果拆去B装置,可能的后果是__________________________。
(3)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_________________;
(4)为了顺利完成实验,正确的操作是________(填序号).
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(5)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓_____________(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
II.实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.1000 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是 _____________________________
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(6)使用酸碱中和滴定的方法,用0.01 moL/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是___________________
A用量筒量取浓盐酸配制0.01 mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
B配制稀盐酸定容时,俯视容量瓶刻度线
C滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴
D滴定过程中用少量蒸馏水将锥形瓶内壁附着的盐酸冲下
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com