
【题目】I硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,而且不需要加热,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方式:___________________ 。
(2)E装置的作用是_______________。如果拆去B装置,可能的后果是__________________________。
(3)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_________________;
(4)为了顺利完成实验,正确的操作是________(填序号).
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(5)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓_____________(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
II.实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.1000 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是 _____________________________
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(6)使用酸碱中和滴定的方法,用0.01 moL/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是___________________
A用量筒量取浓盐酸配制0.01 mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
B配制稀盐酸定容时,俯视容量瓶刻度线
C滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴
D滴定过程中用少量蒸馏水将锥形瓶内壁附着的盐酸冲下
【答案】2MnO4- + 10Cl- +16H+ =2Mn2+ +8H2O+5Cl2↑冷却和收集三氯化硼硼粉遇氯化氢反应,产生氢气,加热条件下氢气和氯气的混合气体易爆炸BCl3 + 3H2O= H3BO3 + 3HCl↑①NaOHDA C
【解析】
(1)在A装置中用高锰酸钾固体粉末与浓盐酸发生反应可以制取氯气,反应的方程式为:2MnO4- + 10Cl- +16H+ =2Mn2+ +8H2O+5Cl2↑;(2)由于浓盐酸有挥发性,所以在氯气中含有HCl气体,用饱和NaCl溶液除去HCl杂质,用浓硫酸进行干燥,在D中发生反应:3Cl2 +2B![]() 2BCl3 ;在 E装置的作用是冷却和收集三氯化硼;如果拆去B装置,可能会发生反应2B+6HCl
2BCl3 ;在 E装置的作用是冷却和收集三氯化硼;如果拆去B装置,可能会发生反应2B+6HCl![]() 2BCl3 ↑+3H2 ↑,在D中加热氢气与氯气的混合气体,易发生爆炸;(3)三氯化硼遇水剧烈反应生成硼酸(H3BO3 )和白雾,该反应的化学方程式是BCl3 +3H2O=H3 BO3 +3HCl↑;因此在实验室保存三氯化硼的注意事项要密封保存,防止受潮水解;(4)①先点燃A处酒精灯,待整套装置中都充满Cl2 后再点燃D处酒精灯,使之发生反应,故正确。②若先点燃D处酒精灯,这时B就与装置中的空气发生反应得到B2O3 ,再点燃A处酒精灯也不能产生BCl3了,故错误。③同时点燃A、D处酒精灯也会导致产生B2O3 ,影响制备BCl3,故错误,答案选①;(5)由于B的性质与Al相似,既能与强酸反应,也能与强碱反应放出氢气,所以取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉;II.A、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项A错误;B、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项B错误;C、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项C错误;D、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项D正确;答案选D;(6)A、用量筒量取浓盐酸配制0.01 mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸,则浓盐酸被稀释,所配盐酸浓度偏低,滴定时消耗的盐酸体积偏大,测得氢氧化钠的浓度偏高;B、配制稀盐酸定容时,俯视容量瓶刻度线,则所加蒸馏水偏少,盐酸浓度偏高,滴定时消耗的盐酸体积偏小,测得氢氧化钠的浓度偏低;C、滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴,则消耗盐酸体积偏大,所测氢氧化钠溶液浓度偏高;D、滴定过程中用少量蒸馏水将锥形瓶内壁附着的盐酸冲下,不影响滴定结果。答案选AC。
2BCl3 ↑+3H2 ↑,在D中加热氢气与氯气的混合气体,易发生爆炸;(3)三氯化硼遇水剧烈反应生成硼酸(H3BO3 )和白雾,该反应的化学方程式是BCl3 +3H2O=H3 BO3 +3HCl↑;因此在实验室保存三氯化硼的注意事项要密封保存,防止受潮水解;(4)①先点燃A处酒精灯,待整套装置中都充满Cl2 后再点燃D处酒精灯,使之发生反应,故正确。②若先点燃D处酒精灯,这时B就与装置中的空气发生反应得到B2O3 ,再点燃A处酒精灯也不能产生BCl3了,故错误。③同时点燃A、D处酒精灯也会导致产生B2O3 ,影响制备BCl3,故错误,答案选①;(5)由于B的性质与Al相似,既能与强酸反应,也能与强碱反应放出氢气,所以取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉;II.A、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项A错误;B、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项B错误;C、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项C错误;D、NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂,即酚酞,选项D正确;答案选D;(6)A、用量筒量取浓盐酸配制0.01 mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸,则浓盐酸被稀释,所配盐酸浓度偏低,滴定时消耗的盐酸体积偏大,测得氢氧化钠的浓度偏高;B、配制稀盐酸定容时,俯视容量瓶刻度线,则所加蒸馏水偏少,盐酸浓度偏高,滴定时消耗的盐酸体积偏小,测得氢氧化钠的浓度偏低;C、滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴,则消耗盐酸体积偏大,所测氢氧化钠溶液浓度偏高;D、滴定过程中用少量蒸馏水将锥形瓶内壁附着的盐酸冲下,不影响滴定结果。答案选AC。


科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
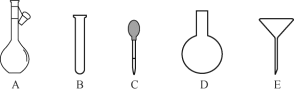
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。
(3)滴定终点的判定现象是________________________________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样wg,消耗c mol/LNH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g) ![]() N2O4(g) ΔH<0,下列说法正确的是( )
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是

A. 由图可知:T1<T2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D. T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙由如下反应制得:
C4H10O![]() C4H8
C4H8 ![]() C4H8Br2(丙)
C4H8Br2(丙)
丙的结构简式不可能是
A. CH3CH2CHBrCH2Br B. CH3CH(CH2Br)2
C. CH3CHBrCHBrCH3 D. (CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:
CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
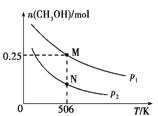
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②506 K时,反应平衡时H2的转化率为___;压强:p1_____(填“>”“<”或“=”) p2。
③反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
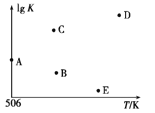
④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。
(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是
A. Fe片与稀H2SO4的反应 B. Ba(OH)28H2O和NH4Cl反应
C. 盐酸和氢氧化钠的反应 D. 镁条在空气中的燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com