
【题目】对已达化学平衡的反应 2X(g)+Y(g)![]() 2Z(g) ΔH<0 下列说法正确的是
2Z(g) ΔH<0 下列说法正确的是
A.减小压强,逆反应速率增大,正反应速率减小,平衡向逆方向移动
B.升高温度,正、逆反应速率均增大,平衡向逆方向移动
C.除去部分的Z,正反应速率增大,逆反应速率减小,平衡向正方向移动
D.加入正催化剂,正、逆反应速率均增大,平衡向正方向移动
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
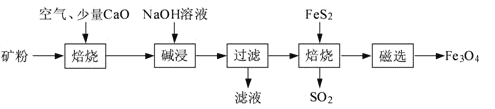
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2![]() ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法正确的是
A.硫黄矿制备硫酸经历两步:S![]() SO3
SO3![]() H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.向溶液中加入BaCl2溶液后滴加硝酸,若产生不溶于硝酸的白色沉淀,则溶液必含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为测定中和热的实验装置图。请回答下列问题:
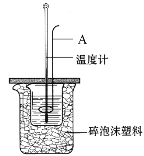
①仪器A的名称为___;
②如果用0.50mol·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将___(填“偏大”、“偏小”或“不变”)
(2)近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

①根据如图,请写出系统(II)中制氢的热化学方程式___;
②系统(I)和系统(II)相比,制得等量H2所需能量较少的是__(填“I”或“II”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,只可能含有 NH4+、Na+、Mg2+、Ba2+、Fe3+、Clˉ、Brˉ、Iˉ、CO32ˉ、SO42—中的几种,且浓度均为 0.1mol L—1。进行以下实验:
①取少量溶液,滴加盐酸至溶液呈酸性,无明显现象。
②取少量溶液,滴加少许新制氯水,再加淀粉溶液,溶液变蓝
③取少量溶液,向其中逐滴加入 NaOH 溶液至碱性,过程中均无沉淀产生。将此溶液分为两等份,第一份加热,有气体放出;第二份溶液中加入Na2CO3 溶液,有白色沉淀生成。下列结论不正确的是
A.肯定含有的阳离子是 NH4+、Ba2+
B.肯定含有的阴离子是Iˉ、Clˉ、Brˉ
C.肯定不含有的离子是 Fe3+、CO32ˉ、SO42ˉ
D.不能确定是否含有的离子是 Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出“海洋元素”的元素符号_____________,②写出钡餐的化学式:_____________。
(2)镁失火时不能用二氧化碳灭火,用化学方程式表示其原因_____________。
(3)《新修本草》有云:“青矾( FeSO4·7H2O)本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”根据以上信息,写出“青矾”受热分解的化学方程式_____________。
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:_____________MnO4ˉ+_____________H2O2+_____________=_____________Mn2++_____________H2O+_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①CH3COONa溶液呈碱性,原因是____________________(用化学用语表达)。
②在CH3COONa溶液中,各个离子浓度大小关系为_________________________
③写出碳酸钠溶液中电荷守恒关系式_________________________________________
(2)已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应是________(填“吸热”或“放热”)反应。
②它若反应消耗24gC(s),则反应吸收的热量为___________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下表中数据:
CO2(g)+H2(g),得到下表中数据:
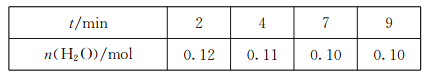
①2min内,v(CO)=________。
②该温度下,此反应的平衡常数的值是________。
③其他条件不变,再充入0.1molCO和0.molH2O(g),达到平衡时CO的体积分数_____(填“增大”“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极。请回答下列问题:
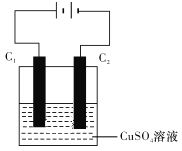
①C1作______(填“阳极”或“阴极”)。
②C2电极的电极反应式为___________。
③惰性电极电解CuSO4溶液的化学方程式是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示装置中加入一定量的铁粉,分液漏斗中加入一定体积浓度为12 mol·L-1的硝酸,加热打开分液漏斗的活塞,使其充分反应后,
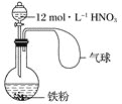
下列微粒:①![]() 、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
A.①B.①⑤C.②④⑤D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com