
【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,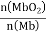 =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。
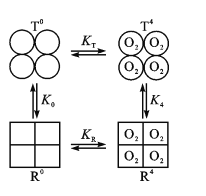
①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
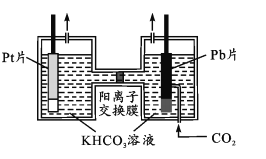
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。
【答案】< 较高 增大氧分压,反应①正向移动,产生较高浓度的H+,从而反应②平衡逆向移动 不变 98% 1.0×10-8 < 7CO2+6e-+5H2O=CH3OH+6HCO3- 减压蒸馏
【解析】
(1)根据反应自发进行的依据判断;根据平衡移动原理分析判断;
(2)化学平衡常数只与温度有关,温度不变,化学平衡常数不变;根据化学平衡常数与O2的结合度的关系计算;
(3)①先计算氧气变化的物质的量,然后根据反应中氧气与T4的量变化关系,计算用T表示的反应速率v(T4);
②根据物质转化关系,分别用K0、K4、KT、KR表示,结合KR>KT,推导K0、K4的大小关系;
(4)在阴极上CO2得到电子,变为CH3OH及HCO3-,据此书写电极反应式;根据甲醇熔沸点低分析判断分离方法。
(1)对于反应HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq),△S<0,若该反应可自发进行,则根据反应自发进行的判断依据△G=△H-T△S<0,所以ΔH<0;根据反应①:HbH+(aq)+O2(g)
HbO2(aq)+H+(aq),△S<0,若该反应可自发进行,则根据反应自发进行的判断依据△G=△H-T△S<0,所以ΔH<0;根据反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)可知:增大氧分压,反应①正向移动,产生较高浓度的H+,H+浓度增大,反应②:CO2+H2O
HbO2(aq)+H+(aq)可知:增大氧分压,反应①正向移动,产生较高浓度的H+,H+浓度增大,反应②:CO2+H2O![]() H++HCO3-的平衡逆向移动,从而可降低血液中CO2的浓度,有利于将CO2排出体外;
H++HCO3-的平衡逆向移动,从而可降低血液中CO2的浓度,有利于将CO2排出体外;
(2)由于只增大氧气的分压,温度不变,化学平衡常数只与温度有关,温度不变,则化学平衡常数K不变;在氧分压p(O2)=2.00 kPa 的平衡体系中,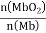 =4.0,则该温度下该反应的化学平衡常数K=
=4.0,则该温度下该反应的化学平衡常数K=![]() =2.0,温度不变,吸入的空气中p(O2)=21 kPa,假设此时 Mb与氧气的最大结合度为x,则由于化学平衡常数K=
=2.0,温度不变,吸入的空气中p(O2)=21 kPa,假设此时 Mb与氧气的最大结合度为x,则由于化学平衡常数K=![]() ,则x=
,则x= =98%;
=98%;
(3)根据表格数据可知在2.0 min~8.0 min内O2的物质的量变化了△n(O2)=(1.64 -1.40)×10-6 mol=2.4×10-7mol,则根据O2与T4变化的物质的量的比是4:1,所△n(T4)=![]() △n(O2)=6.0×10-8 mol,所以以T变化表示的反应速率v(T4)=6.0×10-8 mol÷6 min=1.0×10-8 mol/min;
△n(O2)=6.0×10-8 mol,所以以T变化表示的反应速率v(T4)=6.0×10-8 mol÷6 min=1.0×10-8 mol/min;
②根据物质转化关系可知:K0=![]() ,K4=
,K4=![]() ,KT=
,KT=![]() ,KR=
,KR=![]() ,由于KR>KT,则
,由于KR>KT,则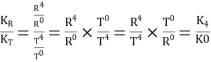 >1,所以K4>K0,即K0<K4;
>1,所以K4>K0,即K0<K4;
(4)CO2中C元素化合价为+4价,在阴极上CO2得到电子,变为CH3OH中C的-2价,同时产生HCO3-,则阳极的电极反应式为:7CO2+6e-+5H2O=CH3OH+6HCO3-;阳极上水电离产生的OH-失去电子变为O2,因此可使氧气再生;由于甲醇属于分子晶体,物质的熔沸点比较低,而NaHCO3熔沸点高,减小压强,物质的熔沸点会降低,因此从电解后溶液中分离甲醇的操作方法是减压蒸馏法。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知水的电离方程式是H2O![]() H++ OH-。下列叙述正确的是( )
H++ OH-。下列叙述正确的是( )
A.升高温度,KW增大,pH不变
B.向水中加入少量硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
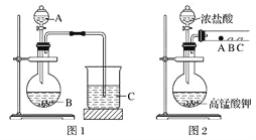
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
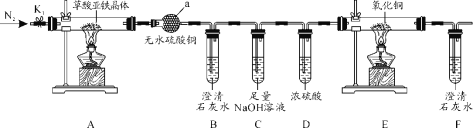
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
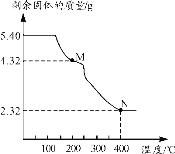
①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol,一定条件下体系中各物质浓度随时间变化的曲线如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol,一定条件下体系中各物质浓度随时间变化的曲线如图所示。下列说法正确的是( )
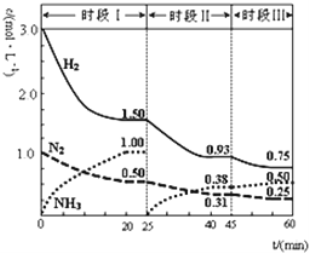
A.前20分钟内反应放出的热量为46.2kJ
B.时段Ⅰ,若仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变
C.第25分钟改变的条件可以是将NH3从反应体系中分离出去
D.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件一定是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com