
【题目】科学防护对预防病毒感染非常重要,下列说法错误的是
A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间
B.制作防护服和口罩的无纺布是有机高分子材料
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.二氧化氯泡腾片可用于水处理
科目:高中化学 来源: 题型:
【题目】卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题: 
(1)d为 , 从d的水溶液中提取d的方法是 .
(2)红热的铜丝与b单质反应的现象为 .
(3)a与H2反应的化学方程式为 , b与H2反应的条件为 .
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+![]() O2(g)== CO2(g) △H1=﹣283.0kJ/mol
O2(g)== CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+![]() O2(g)== H2O(g)△H2=﹣241.8kJ/mol
O2(g)== H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+![]() O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
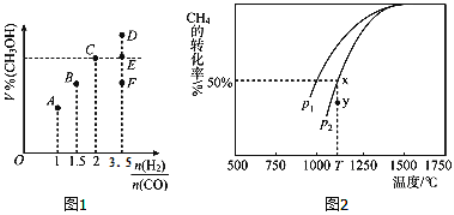
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2。写出相关反应的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A,B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是;
②当A,B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移: .
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示) .
(2)若A为单质,B为无色油状黏稠液体,当 A,B的物质的量之比为1:2时,则A可能为 , 检查其中刺激性气体产物X的方法是 .
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为 .
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:2时,则被还原的X是mol.
(4)若A,B,X,Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 .
(5)若A,B,X,Y均为化合物.X为极易溶于水的气体,则盐A是盐,生成气体X的离子方程式为 , 检验该气体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种盐酸跟锌片反应,起始时反应速率最快的是
A.10 ℃ 20 mL 3 mol/L的盐酸 B.10 ℃ 40 mL 2 mol/L的盐酸
C.20 ℃ 20 mL 2 mol/L的盐酸 D.20 ℃ 10 mL 4 mol/L的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com