
【题目】晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O剧烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是__________________________________,装置D不能采用普通玻璃管的原因是_____________________________,装置D中发生反应的化学方程式为_________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及______________。
【答案】 SiO2+2C![]() Si+2CO↑ 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl3+H2
Si+2CO↑ 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl3+H2![]() Si+3HCl 排尽装置中的空气
Si+3HCl 排尽装置中的空气
【解析】
(1)高温下用碳与二氧化硅发生置换反应:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)①通过锌与稀硫酸反应制备的氢气中混有水蒸气,但SiHCl3能与H2O剧烈反应,在空气中易自燃,应在氢气参加反应前先干燥,所以B中的试剂是浓硫酸; C装置的目的是使SiHCl3和氢气充分混合,进而进入D装置中反应,因此加热C的目的是使SiHCl3汽化;②D中SiHCl3和氢气反应生成固体硅,反应方程式为:SiHCl3+H2![]() Si+3HCl,因为反应加热到1000~1100℃,所以必须用石英管。③由于在高温下硅和氧气可以化合生成二氧化硅,所以必须排尽装置中的空气。
Si+3HCl,因为反应加热到1000~1100℃,所以必须用石英管。③由于在高温下硅和氧气可以化合生成二氧化硅,所以必须排尽装置中的空气。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下产生乙烯,并检验乙烯性质的实验。
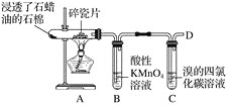
回答下列问题:
(1)从装置A中出来的气体中含有烷烃和________。
(2)B中酸性高锰酸钾溶液________,这是因为生成的气体被________(填“氧化”或“还原”),反应类型为________。
(3)C中溴的四氯化碳溶液________,发生反应的化学方程式:____________,反应类型为________。
(4)在D处点燃之前必须进行的操作是__________,燃烧时反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制取Cl2时,下列操作不正确的是________(填序号)。


①装置Ⅰ可用于制取少量Cl2
②用装置Ⅱ除去Cl2中的少量HCl
③用装置Ⅲ制取Cl2
④用装置Ⅳ干燥Cl2
(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂有_______、______、______。
(3)已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如下图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是________(填字母,下同)。

(4)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的装置正确的是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由什么因素决定的( )
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
A.①②B.①③C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了如下3个实验方案,用以检验淀粉的水解程度:
甲方案:淀粉液 ![]() 水解液
水解液 ![]() 中和液
中和液 ![]() 溶液变蓝
溶液变蓝
结论:淀粉尚未水解
乙方案:淀粉液 ![]() 水解液
水解液 ![]() 无银镜现象
无银镜现象
结论:淀粉尚未水解
丙方案:淀粉液 ![]() 水解液
水解液 ![]() 中和液
中和液 
结论:淀粉水解完全
上述三种方案操作是否正确 说明理由。上述三种方案结论是否正确 说明理由。 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图所示。

(1)“苦卤”到“含Br2的海水”过程____(填“是”或“不是”)氧化还原反应。
(2)步骤④利用了S02的还原性,反应的离子方程式为____。
(3)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,其原因是____。
(4)若处理1 m3海水需要消耗0.45 molSO2,不考虑转化过程中溴的损耗,则海水中溴离子的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 1L0.1mol·L-1CH3COOH溶液中含H+的数目为0.1NA
B. 标准状况下,2.24LCl2 溶于水,转移的电子数为0.1NA
C. 100g质量分数为46%的酒精溶液中含氧原子总数为4NA
D. 常温下,将1molFe加入足量硝酸中,生成H2的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com